
| A. |  实验测定氯水的pH | |
| B. | 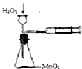 实验定量测定H2O2的分解速率 | |
| C. | 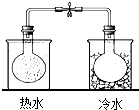 实验中利用NO2颜色的变化验证其中反应的热效应 | |
| D. | 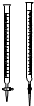 实验中(乙)管内盛放已知浓度的KMnO4溶液来测定FeSO4溶液的浓度 |
分析 A.氯气具有漂白性;
B.不能用长颈漏斗;
C.升高温度向吸热方向移动,溶液变深;
D.高锰酸钾腐蚀橡皮管.
解答 解:A.氯气具有漂白性,不能测定pH试纸,故A错误;
B.要使用分液漏斗不能属于长颈漏斗,否则生成的气体易泄漏而导致测量不准确,故B错误;
C.热水中变深、冰水中变浅,说明升高温度向逆方向移动,则逆方向为吸热反应,则正方向为放热反应,故C正确;
D.高锰酸钾腐蚀橡皮管,应把高锰酸钾放在酸式滴定管中,故D错误.
故选C.
点评 本题考查了实验方案评价,涉及反应速率的测定、反应热的判断、pH的测定等知识点,根据仪器的作用、反应条件、对比实验特点等知识点来分析解答,易错选项是C,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | +30.0kJ?mol-1 | B. | -80.5kJ?mol-1 | C. | -30.0kJ?mol-1 | D. | +80.5kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
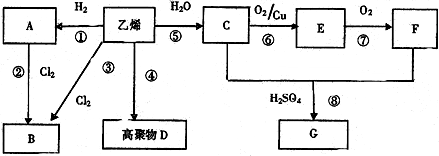
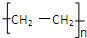 ,F中所含官能团的名称是羧基;A的二溴代物的结构有2种.
,F中所含官能团的名称是羧基;A的二溴代物的结构有2种.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物 质 | 需加入的试剂 | 有关离子方程式 |
| HNO3(HCl) | ||
| ZnSO4(CuSO4) | ||
| NaCl(Na2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
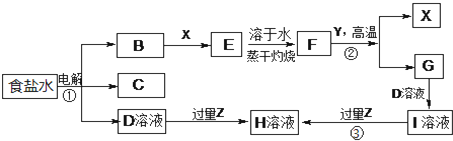
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制FeSO4溶液时,需加入少量铁粉和稀盐酸,既防止氧化又抑制水解 | |
| B. | 向纯水中加入盐酸或降温都能使电离平衡逆向移动,但水的离子积不变 | |
| C. | 在滴有酚酞的Na2CO3溶液中,加入BaCl2溶液后红色褪去,验证Na2CO3溶液中存在水解平衡 | |
| D. | 已知I3-?I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol Fe3+完全水解,生成氢氧化铁胶体的数目为NA | |
| B. | 22.4 LCl2 分别与足量的Cu、Fe完全反应转移电子数分别为2 NA、3NA | |
| C. | 室温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为1.5 NA | |
| D. | 1 mol/L Mg(NO3)2溶液中含有NO3-的数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X>Z>Y>M | B. | X>M>Z>Y | C. | M>Y>Z>X | D. | M>X>Z>Y |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com