
| A.石灰水 | B.无水乙醇 | C.硝酸 | D.盐酸 |
 CH3CHO+H2O+Cu,又恢复为铜,铜片的质量不变,故B错误;铜片在酒精灯上加热后生成CuO,质量增加,将它投入硝酸中,发生反应:CuO+2HNO3=Cu(NO3)2+H2O,Cu2+进入溶液,铜片的质量会减小,故C错误;与C同理,铜片的质量会减小,故D错误,答案选A。
CH3CHO+H2O+Cu,又恢复为铜,铜片的质量不变,故B错误;铜片在酒精灯上加热后生成CuO,质量增加,将它投入硝酸中,发生反应:CuO+2HNO3=Cu(NO3)2+H2O,Cu2+进入溶液,铜片的质量会减小,故C错误;与C同理,铜片的质量会减小,故D错误,答案选A。

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源:不详 题型:实验题
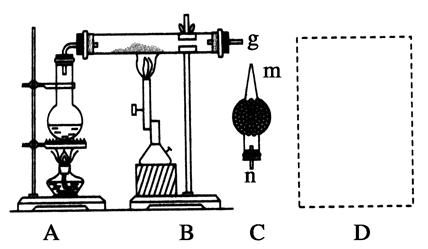
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
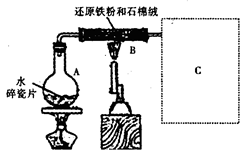
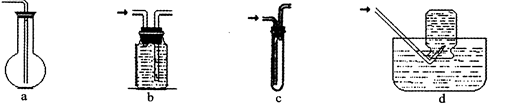
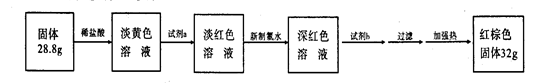
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
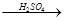 H2
H2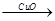 Cu ②CuO
Cu ②CuO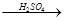 CuSO4
CuSO4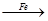 Cu
Cu| A.①多 | B.②多 | C.相等 | D.无法判断 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用盐酸可以洗去铜表面的铜锈 |
| B.向氯化铁溶液中加入适量氧化铜固体,可得到红褐色沉淀 |
| C.0.1mol/L的CuSO4溶液中,Cu2+的微粒数目一定小于0.1NA(设NA为阿伏伽德罗常数) |
| D.在FeSO4溶液中加入CuS固体,溶液中c(Fe2+)不变,说明Ksp(CuS)远小于Ksp(FeS) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | 实 验 | 预 测 |
| A | 蒸发FeCl3溶液 | 得到FeCl3固体 |
| B | 在FeCl3、CuCl2混合液中,加入少量Fe粉 | 一定有H2产生且有Cu析出 |
| C | 用FeCl3固体溶于水配制饱和溶液 | 会有Fe(OH)3沉淀产生 |
| D | 在FeCl3溶液中,加入KHCO3溶液 | 有CO2产生,但无Fe(OH)3沉淀生成 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
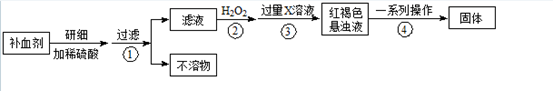
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com