
分析 已知①CH4(g)+202(g)=CO2 (g)+2H2O(l)△H1=-890.3kJ/mol;
②C(石墨,s)+O2(g)=CO2(g)△H2=-393.53kJ/mol;
③H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H3=-285.8kJ/mol;
由盖斯定律可知,②+2×③-①可得C(石墨,s)+2H2(g)═CH4(g)△H.
解答 解:已知①CH4(g)+202(g)=CO2 (g)+2H2O(l)△H1=-890.3kJ/mol,
②C(石墨,s)+O2(g)=CO2(g)△H2=-393.53kJ/mol,
③H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H3=-285.8kJ/mol,
由盖斯定律可知,②+2×③-①可得C(石墨,s)+2H2(g)═CH4(g)△H=-393.53kJ/mol+2×(-285.8kJ/mol)-(-890.3kJ/mol)=-74.8 kJ/mol,
故答案为:-74.8 kJ/mol.
点评 本题考查了用盖斯定律进行有关反应热的计算,题目难度不大,明确盖斯定律的内容及应用方法为解答关键,首先写出热化学方程式的方程式部分,然后以该方程式为目标对已知热化学方程式进行变形,试题培养了学生的分析能力及灵活应用能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 按系统命名法,化合物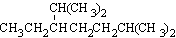 的名称为2,6-二甲基-5-乙基庚烷 的名称为2,6-二甲基-5-乙基庚烷 | |
| B. | 苯和油脂均不能使酸性KMnO4溶液褪色 | |
| C. | 有机物X的蒸气相对氢气的密度为51,X中氧元素的质量分数为31.7%,则能在碱性溶液中发生反应的X的同分异构体有(不考立体异构)13种 | |
| D. | 检验卤代烃中的卤素原子种类的方法是:加入NaOH溶液共热,再加AgNO3溶液,观察沉淀颜色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 现象 | 结论 |
| ①分别取等体积的2mol/L的硫酸于试管中;②分别投入大小、形状相同的Al、Fe、Mg | 反应快慢:Mg>Al>Fe | 反应物的性质越活泼,反应速率越快 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
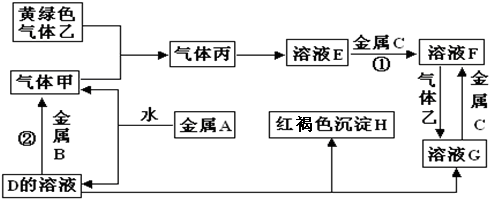
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
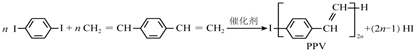
| A. | 合成PPV的反应为加聚反应 | |
| B. | PPV与聚苯乙烯具有相同的重复结构单元 | |
| C. |  和苯乙烯互为同系物 和苯乙烯互为同系物 | |
| D. | 1mol 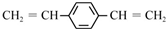 最多可以和5mol氢气发生加成反应 最多可以和5mol氢气发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙烷分子中3个碳原子一定在同一条直线上 | |
| B. | 甲苯分子中7个碳原子都在同一平面上 | |
| C. | 3-甲基-1-丁炔分子中所有碳原子都在同一平面上 | |
| D. | 2-丁烯分子中4个碳原子有可能在同一条直线上 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
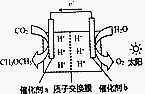 模拟植物的光合作用,利用太阳能将H2O和CO2化合生成二甲醚(CH3OCH3),装置如图所示,下列说法错误的是( )
模拟植物的光合作用,利用太阳能将H2O和CO2化合生成二甲醚(CH3OCH3),装置如图所示,下列说法错误的是( )| A. | H+由交换膜右侧向左侧迁移 | |
| B. | 催化剂a表面发生的反应是2CO2+12e-+12H+═CH3OCH3+3H2O | |
| C. | 该过程是太阳能转化为化学能的过程 | |
| D. | 消耗CO2与生成O2体积比为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯酚、甲醛通过加聚反应可制得酚醛树脂 | |
| B. | 75%的酒精可使蛋白质变性从而起到消毒作用 | |
| C. | 纤维素在人体内可水解成葡萄糖,供人体组织的营养需要 | |
| D. | 天然植物油常温下一般呈液态,难溶于水,有恒定的熔点、沸点 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com