

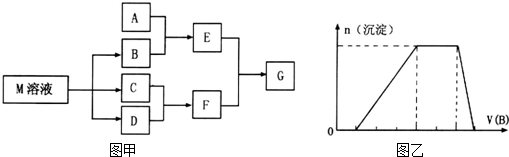
分析 (1)A可用于自来水消毒,A为Cl2,D是一种金属单质,由转化关系可知,D为变价金属,则D为Fe,B为FeCl3,C为FeCl2;
(2)若A是一种碱性气体,常用作制冷剂,B是汽车尾气之一,遇空气会变色,则A是NH3,B为NO,D为O2,C为NO2;
(3)A、B、C的焰色反应都呈黄色,均含有Na元素,D是一种造成酸雨危害的气体,则D为SO2,A为NaOH,B为Na2SO3,C为NaHSO3;
(4)若A是生产、生活中用量最大、用途最广的金属单质,则A为Fe,D是硝酸(假设稀硝酸的还原产物只有NO,浓硝酸的还原产物只有NO2),则B为Fe(NO3)2,C为Fe(NO3)3.溶液中氢离子为1L×1mol/L=1mol,反应生成无色气体为$\frac{6.72L}{22.4L/mol}$=0.3mol,若全部为硝酸,由3Fe+2NO3-+8H+=3Fe2++2NO↑+4H2O,可知生成NO为1mol×$\frac{2}{8}$=0.25mol,若全部为硫酸,生成气体为0.5mol,实际生成气体介于二者之间,故生成的气体为NO、氢气混合气体,则混酸中硝酸全部被还原,反应后溶液中溶质为FeSO4,设混酸中硝酸为xmol、硫酸为ymol,表示出生成NO、氢气物质的量,根据氢离子总量、氢气物质的量列方程计算.
解答 解:(1)A可用于自来水消毒,A为Cl2,D是一种金属单质,由转化关系可知,D为变价金属,则D为Fe,B为FeCl3,C为FeCl2,溶液C久置于空气中,则可以证明其是否变质的试剂是:KSCN溶液,工业上制取A的离子方程式为:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑,
故答案为:KSCN溶液;2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑;
(2)若A是一种碱性气体,常用作制冷剂,B是汽车尾气之一,遇空气会变色,则A是NH3,B为NO,D为O2,C为NO2,反应①的化学方程式为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,
故答案为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;
(3)A、B、C的焰色反应都呈黄色,均含有Na元素,D是一种造成酸雨危害的气体,则D为SO2,A为NaOH,B为Na2SO3,C为NaHSO3,由A、C反应生成B的离子方程式:HSO3-+OH-=SO32-+H2O,
故答案为:HSO3-+OH-=SO32-+H2O;
若A是生产、生活中用量最大、用途最广的金属单质,则A为Fe,D是硝酸(假设稀硝酸的还原产物只有NO,浓硝酸的还原产物只有NO2),则B为Fe(NO3)2,C为Fe(NO3)3.
溶液中氢离子为1L×1mol/L=1mol,反应生成无色气体为$\frac{6.72L}{22.4L/mol}$=0.3mol,若全部为硝酸,由3Fe+2NO3-+8H+=3Fe2++2NO↑+4H2O,可知生成NO为1mol×$\frac{2}{8}$=0.25mol,若全部为硫酸,生成气体为0.5mol,实际生成气体介于二者之间,故生成的气体为NO、氢气混合气体,则混酸中硝酸全部被还原,反应后溶液中溶质为FeSO4,设混酸中硝酸为xmol、硫酸为ymol,则x+2y=1,由3Fe+2NO3-+8H+=3Fe2++2NO↑+4H2O,可知消耗氢离子为4x mol,生成NO为x mol,根据H原子守恒可知生成氢气为$\frac{1}{2}$×(1mol-4xmol),则:
x mol+$\frac{1}{2}$×(1mol-4xmol)=0.3mol,解得x=0.2、y=0.4,原溶液中硝酸的物质的量浓度为 $\frac{0.2mol}{1L}$=0.2mol/L,最终得到的溶液中溶质FeSO4的物质的量为0.4mol,
故答案为:0.2mol/L;0.4mol.
点评 本题考查无机物推断,属于开放性题目,需要学生熟练掌握元素化合物知识,(4)中计算关键是利用极限法判断生成生成气体组成,难度中等.


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (3)装置B中试剂的作用是检验SO2是否除尽.
(3)装置B中试剂的作用是检验SO2是否除尽.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
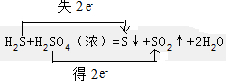 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 乳酸亚铁{[CH3CH(OH)COO]2Fe}广泛应用于乳制品、营养液等,溶于水,可由乳酸与FeCO3反应制得.
乳酸亚铁{[CH3CH(OH)COO]2Fe}广泛应用于乳制品、营养液等,溶于水,可由乳酸与FeCO3反应制得.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com