
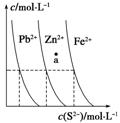
 如图为某温度下,PbS(s)、ZnS(s)、FeS(s)分别在溶液中达到沉淀溶解平衡后,溶液的S2-浓度、金属阳离子浓度变化情况。下列说法正确的是( )
如图为某温度下,PbS(s)、ZnS(s)、FeS(s)分别在溶液中达到沉淀溶解平衡后,溶液的S2-浓度、金属阳离子浓度变化情况。下列说法正确的是( )
A.三种难溶物的溶度积Ksp(FeS)的最小
B.如果向三种沉淀中加盐酸,最先溶解的是PbS
C.向新生成的ZnS浊液中滴入足量含相同浓度的Pb2+、Fe2+的溶液,振荡后,ZnS沉淀会转化为PbS沉淀
D.对于三种难溶物来讲,a点对应的都是不饱和溶液
科目:高中化学 来源: 题型:
某化学科研小组研究在其他条件不变时,改变某一条件对可逆反应aA(g)+bB(g)  cC(g)化学平衡的影响,得到如下图象(图中p表示压强,T表示温度,n表示物质的量,α表示平衡转化率,
cC(g)化学平衡的影响,得到如下图象(图中p表示压强,T表示温度,n表示物质的量,α表示平衡转化率,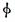 表示体积分数)。根据图象,下列判断正确的是( )
表示体积分数)。根据图象,下列判断正确的是( )
A.反应Ⅰ:若p1>p2,则此反应只能在高温下自发进行
B.反应Ⅱ:此反应的ΔH<0,且T1<T2
C.反应Ⅲ:ΔH>0且T2>T1或ΔH<0且T2<T1
D.反应Ⅳ:T1<T2,则该反应不易自发进行
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素A、B、C、D、E,已知A、B为金属,C、D、E为非金属,C是最活泼的非金属,E与C同主族,D离子半径比E离子半径大。A、B的离子与C离子电子层结构相同,其中B离子的半径最小。下列有关说法错误的是
A.含氧酸的酸性: E>D B.原子半径:A>B
C.氢化物的热稳定性:C>E D.离子结合质子能力:D>E
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,下列说法正确的是( )
A.常温下,pH相等的NaOH溶液和CH3COONa溶液中由水电离产生的c(OH-)相等
B.由水电离的c(H+)=1×10-11 mol·L-1的溶液一定是碱性溶液
C.两种难溶性盐,Ksp较小的,其溶解度也一定较小
D.Na2CO3溶液和NaHCO3溶液中一定都存在:
2c(CO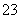 )+c(OH-)+c(HCO
)+c(OH-)+c(HCO )=c(H+)+c(Na+)
)=c(H+)+c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关说法正确的是( )
A.信息产业中的光缆的主要成分是单质硅
B.利用激光笔可以区别鸡蛋清和浓盐水
C.油脂、糖类、蛋白质都属于天然高分子化合物
D.煤经气化、液化和干馏三个物理变化过程,可变为清洁能源
查看答案和解析>>
科目:高中化学 来源: 题型:
Na、Fe、Cu、Al是常见的金属元素,请按要求回答下列问题:
(1)一定条件下,2.3 g的Na与O2完全反应生成3.6 g产物时失去的电子数为________。
(2)向氯化铜溶液中加入一定量的铁粉和铝粉混合物,充分反应后,下列情况可能出现的是________(填字母)。
a.溶液中有Cu2+、Fe2+、Al3+,不溶物为Cu
b.溶液中有Fe2+、Al3+,不溶物为Cu、Fe
c.溶液中有Fe3+、Al3+,不溶物为Cu
d.溶液中有Fe2+,不溶物为Cu、Al
(3)将一定质量的铁、铝、铜合金,加入1 L一定物质的量浓度的硝酸中,合金完全溶解,测得溶液中(忽略溶液体积的变化)c(H+)=0.5 mol·L-1,c(Cu2+)=0.3 mol·L-1,c(Al3+)=0.2 mol·L-1,c(NO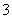 )=2 mol·L-1,则混合物中铁的质量最少为________。
)=2 mol·L-1,则混合物中铁的质量最少为________。
(4)铁的某种氧化物的化学式表示为FexO(x<1),已知铁元素在该氧化物中的质量分数为75%,则x=______(精确至0.01)。
(5)Na—Al/FeS是一种可充电电池,电池中用含Na+导电固体作为电解质,在工作过程中Na+的物质的量保持不变。
①若该正极的电极反应式表示为2Na++FeS+2e-===Na2S+Fe,则电池的负极反应式可表示为________________;充电时,阳极发生反应的物质是________。
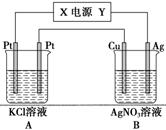
②用该电池作电源,组成如图所示装置,若通电5 min时,铜电极质量增加1.08 g,则该电源电极X名称为________。图中装置A、B的pH变化为A__________、B________(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列分子中,各分子的空间构型和中心原子的杂化方式均正确的是 ( )
A、NH3 平面三角形 sp3杂化 B、CCl4 正四面体 sp3杂化
C、H2O V形 sp2杂化 D、CO32- 三角锥形 sp3杂化
查看答案和解析>>
科目:高中化学 来源: 题型:
NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
 (1)NH4Al(SO4)2可作净水剂,其原理是___________________________
(1)NH4Al(SO4)2可作净水剂,其原理是___________________________
_
(用必要的化学用语和相关文字说明)。
(2)相同条件下,0.1 mol·L-1 NH4Al(SO4)2溶液中c(NH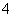 )________(填“等于”、“大于”或“小于”)0.1 mol·L-1 NH4HSO4溶液中c(NH
)________(填“等于”、“大于”或“小于”)0.1 mol·L-1 NH4HSO4溶液中c(NH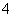 )。
)。
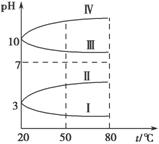
(3)均为0.1 mol·L-1的几种电解质溶液的pH随温度变化的曲线如图所示。
①其中符合0.1 mol·L-1 NH4Al(SO4)2溶液的pH随温度变化的曲线是________(填字母),导致pH随温度变化的原因是 ;
 ②20 ℃时,0.1 mol·L-1 NH4Al(SO4)2溶液中2c(SO
②20 ℃时,0.1 mol·L-1 NH4Al(SO4)2溶液中2c(SO )-c(NH
)-c(NH )-3c(Al3+)=________。
)-3c(Al3+)=________。
(4)室温时,向100 mL 0.1 mol·L-1 NH4HSO4溶液中滴加0.1 mol·L-1 NaOH溶液,溶液pH与NaOH溶液体积的关系曲线如图所示.试分析图中a、b、c、d四个点,水的电离程度最大的是________点,在b点,溶液中各离子浓度由大到小的排列顺序是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com