
分析 X、Y、Z三种气体都能造成大气污染.在工业上都可以用碱液吸收.已知X是化石燃科燃烧的产物之一,是形成酸雨的主要原因,则X是二氧化硫;Y是一种单质,它的水溶液具有漂白性,则Y是氯气;Z是硝酸工业和汽车尾气中的有害物质之一,能与水反应,则Z是二氧化氮,结合物质的性质解答.
解答 解:(1)二氧化硫是化石燃科燃烧的产物之一,是形成酸雨的主要原因,化学式为:SO2;
故答案为:SO2;
(2)二氧化氮是硝酸工业和汽车尾气中的有害物质之一,能与水反应生成硝酸也一氧化氮,二氧化氮为红棕色气体;
故答案为:红棕色;
(3)二氧化硫能与有色物质化合生成无色物质,所以具有漂白性,二氧化硫还具有还原性,能够与氯气在水中反应生成硫酸和盐酸,二者都不具有漂白性,方程式:SO2+Cl2+2H2O=2HCl+H2SO4;
故答案为:SO2+Cl2+2H2O=2HCl+H2SO4;
点评 本题考查了元素化合物知识,熟悉二氧化硫、氯气、二氧化氮的性质是解题关键,注意对基础知识的积累,题目难度不大.


科目:高中化学 来源: 题型:解答题
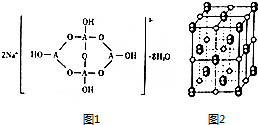 已知A、B、C、D、E五种元素是周期表中前四周期元素,且原子序数依次增大.其中A、B、C为同周期的非金属元素,且B、C原子中均有两个未成对电子.D、E为同周期元素且分别位于s区和d区.五种元素所有的s能级电子均为全充满.E的d能级电子数等于A、B、C最高能层的p能级电子数之和.回答下列问题:
已知A、B、C、D、E五种元素是周期表中前四周期元素,且原子序数依次增大.其中A、B、C为同周期的非金属元素,且B、C原子中均有两个未成对电子.D、E为同周期元素且分别位于s区和d区.五种元素所有的s能级电子均为全充满.E的d能级电子数等于A、B、C最高能层的p能级电子数之和.回答下列问题: .
.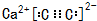 ,若晶胞的长宽高分别为520pm、520pm和690pm,该晶体密度为2.28g/cm3(保留到小数点后两位).
,若晶胞的长宽高分别为520pm、520pm和690pm,该晶体密度为2.28g/cm3(保留到小数点后两位).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
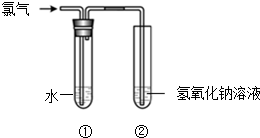 某同学用如图所示装置制取氯水并进行相关实验.
某同学用如图所示装置制取氯水并进行相关实验.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
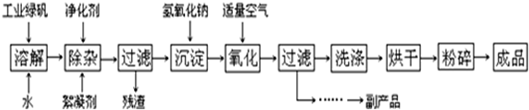
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ④①③② | B. | ①④③② | C. | ①③④② | D. | ④②①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 需要加快反应速率的过程是炼钢 | |
| B. | 世界上第一张元素周期表的作者是门捷列夫 | |
| C. | 乙烯与溴的四氯化碳溶液反应的类型为取代反应 | |
| D. | 在葡萄糖溶液中加入新制的Cu(OH)2,加热煮沸后产生沉淀的颜色为砖红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 未加盐酸时,c (Na+)+c(OH-)=c(NH3•H2O) | |
| B. | 加入10mL盐酸时,c(NH4+)+c(H+)=c(OH-) | |
| C. | 加入盐酸至溶液pH=7时:c(Cl-)=c (Na+) | |
| D. | 加入20mL盐酸时,c(Cl-)=c(NH4+)+c (Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{a-3}{12}$mol | B. | $\frac{a-27}{12}$mol | C. | $\frac{a-81}{18}$mol | D. | $\frac{a-9}{18}$mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com