
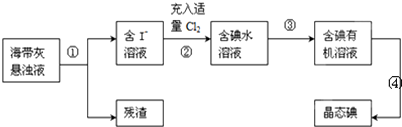
分析 (1)分离固体与液体混合物应用过滤;
(2)氯气具有强的氧化性,能够将碘离子氧化为单质碘;
(3)碘易溶于有机溶剂,分离两种相互溶解的液体应选择分液操作;从碘水中提取碘操作为萃取,结合萃取剂选择原则解答;
(4)从碘水中萃取碘并用分液漏斗分离两种溶液,操作为查漏→装液→振荡→静置→分液,据此排序.
解答 解:(1)依据流程图可知通过操作①将海带灰悬浊液分离为含碘离子的溶液和残渣,分离固体与液体混合物的 操作为过滤,所以①为过滤;
故答案为:过滤;
(2)氯气具有强的氧化性,能够将碘离子氧化为单质碘,所以过程②中充入适量Cl2的目的是使I-完全转化为I2;
故答案为:使I-完全转化为I2;
(3)碘易溶于有机溶剂,从碘水中提取碘操作为萃取,萃取剂选择原则:①和原溶液中的溶剂互不相溶; ②对溶质的溶解度要远大于原溶剂,酒精、醋酸能够与水相溶,所以不能用来萃取碘,碘易溶于有机溶剂,苯、四氯化碳与水互不相溶,可以用来萃取碘;分离两种相互溶解的液体应选择分液操作;
故答案为:萃取 分液;BD;
(4)CCl4从碘水中萃取碘并用分液漏斗分离两种溶液,操作为查漏→装液→振荡→静置→分液,所以正确的顺序为:⑦②①④③⑤⑥;
故答案为:⑦②①④③⑤⑥.
点评 本题以海水提镁的工艺流程为载体考查混合物分离提纯,为高频考点,把握物质的性质选择分离、提纯的方法为解答的关键,侧重分离原理及分离实验步骤的考查,题目难度中等.


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 乙烯、苯、环己烷都属于脂肪烃 | B. | 苯、环戊烷、环己烷同属于芳香烃 | ||
| C. | 乙烯、乙炔同属于烯烃 | D. |  、 、 、 、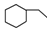 同属于环烷烃 同属于环烷烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大压强,活化分子数增加,化学反应速率一定增大 | |
| B. | 升高温度,活化分子百分数增加,化学反应速率一定增大 | |
| C. | 加入反应物,使活化分子百分数增加,化学反应速率增大 | |
| D. | 使用催化剂,降低了反应的活化能、反应速率加快,但是活化分子百分数不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化合反应 | B. | 分解反应 | C. | 复分解反应 | D. | 置换反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaCl2、Na2CO3、NaOH、盐酸 | B. | NaOH、BaCl2、Na2CO3、盐酸 | ||
| C. | Na2CO3、NaOH、BaCl2、盐酸 | D. | BaCl2、NaOH、Na2CO3、盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
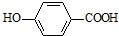 +CH2OH5$\stackrel{催化剂}{→}$
+CH2OH5$\stackrel{催化剂}{→}$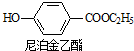 +H2O
+H2O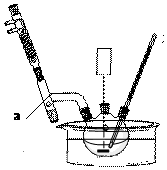
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com