
| A.在纯水中 | B.在0.1 mol·L-1的MgCl2溶液中 |
| C.在0.1 mol·L-1的NH3·H2O中 | D.在0.1 mol·L-1的CH3COOH溶液中 |
 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源:不详 题型:填空题
 4Fe(OH)3+8OH-+_____。
4Fe(OH)3+8OH-+_____。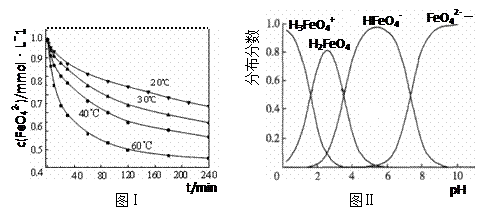
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
| A.将难溶电解质放入纯水中,溶解达到平衡时,升高温度, Ksp 一定增大 |
| B.两种难溶盐电解质,其中Ksp小的溶解度也一定小 |
| C.难溶盐电解质的Ksp与温度有关 |
| D.向AgCl的悬浊液中加入适量的水,使AgCl再次达到溶解平衡,AgCl的Ksp不变,其溶解度也不变 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
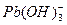 、
、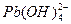 ,各形态的浓度分数α随溶液pH变化的关系如下图所示:
,各形态的浓度分数α随溶液pH变化的关系如下图所示: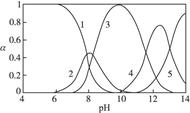
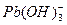 ,5表示
,5表示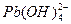
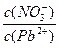 ___________2(填“>”“=”或“<”);往该溶液中滴入氯化铵溶液后,
___________2(填“>”“=”或“<”);往该溶液中滴入氯化铵溶液后, 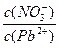 增大,可能的原因是_____________。
增大,可能的原因是_____________。查看答案和解析>>
科目:高中化学 来源:不详 题型:判断题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.水垢的主要成分是MgCO3和CaCO3 |
| B.硬水的软化是将全部的Mg2+、Ca2+除尽 |
| C.加入FeS、MnS以除去工业废水中的Cu2+、Cd2+、Pb2+等重金属离子 |
| D.胃舒平的主要成份是氢氧化铁,可治疗胃酸过量,同时也可补铁。 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| K甲/25℃ | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
| 完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | 3~4 |
| A.向该混合溶液中加入少量铁粉,立即能观察到有红色固体析出 |
| B.向该混合溶液中逐滴加入NaOH溶液,最先看到蓝色沉淀 |
| C.该混合溶液中c(SO42-):{c(Cu2+)+c(Fe2+)+c(Fe3+)}>5:4 |
| D.向该混合溶液中加入适量氯水,并调节溶液的pH为3-4,然后过滤,可得到纯净的CuSO4溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
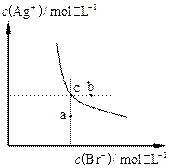
| A.向溴化银的浊液中加入溴化钠溶液, 溴化银的Ksp减小 |
| B.图中a点对应的是不饱和溶液 |
C.向c点的溶液中加入0.1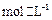 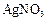 ,则 ,则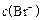 减小 减小 |
| D.升高温度可以实现c点到b点的转化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com