
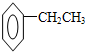 、
、 、
、 、
、 ,若该烃的核磁共振氢谱图有两个吸收峰,则该物质为
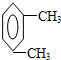
,若该烃的核磁共振氢谱图有两个吸收峰,则该物质为 ,它的名称为1,4-二甲基苯,
,它的名称为1,4-二甲基苯,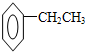 ;
; ;
; ;
; ;1,4-二甲基苯;
;1,4-二甲基苯;


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、HI与HF的沸点 |
| B、zX和(Z+2)Y的原子半径 |
| C、熟石灰在20℃时与60℃时的溶解度 |
| D、质量分数为20%的氨水与质量分数为10%的氨水的密度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 为了控制燃煤电厂所排放的烟气中氮氧化物,目前常采用选择性催化还原法(SCR)进行脱硝.在其脱硝过程中,V2O5-WO3/TiO2催化剂是决定脱硝效率的关键因素.该催化剂随温度的升高其活性会下降,若在反应前期通入SO2,在催化剂表面氧化并最终形成硫酸,增强了催化剂表面的酸性,从而提高了高温下催化剂的活性,根据以上信息,回答问题:
为了控制燃煤电厂所排放的烟气中氮氧化物,目前常采用选择性催化还原法(SCR)进行脱硝.在其脱硝过程中,V2O5-WO3/TiO2催化剂是决定脱硝效率的关键因素.该催化剂随温度的升高其活性会下降,若在反应前期通入SO2,在催化剂表面氧化并最终形成硫酸,增强了催化剂表面的酸性,从而提高了高温下催化剂的活性,根据以上信息,回答问题:查看答案和解析>>
科目:高中化学 来源: 题型:
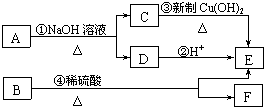
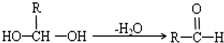 (R代表烃基)
(R代表烃基)查看答案和解析>>
科目:高中化学 来源: 题型:
| A、测得醋酸钠溶液的pH>7 |
| B、测得0.1mol/L醋酸溶液的pH=3.3 |
| C、将pH=1的醋酸溶液稀释1000倍,测得pH<4 |
| D、将等浓度、等体积的醋酸溶液与氢氧化钠溶液混合后恰好中和 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 喀麦隆的“杀人湖”(尼奥斯湖)曾于1986年使1800多名附近居民在一夜之间神秘死去.后经科学家考察发现,湖底有火山口,聚集了大量二氧化碳和二氧化硫等有毒气体并发现在200m深的湖底,每立方米湖水竟溶解8m3的有毒气体,目前科技人员已找到一种有效的办法将湖底的有毒气体抽出并加以处理.回答:
喀麦隆的“杀人湖”(尼奥斯湖)曾于1986年使1800多名附近居民在一夜之间神秘死去.后经科学家考察发现,湖底有火山口,聚集了大量二氧化碳和二氧化硫等有毒气体并发现在200m深的湖底,每立方米湖水竟溶解8m3的有毒气体,目前科技人员已找到一种有效的办法将湖底的有毒气体抽出并加以处理.回答:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、消耗1mol氧气时转移4mole-,H+向正极移动 |
| B、电池负极的反应为:C6H12O6+6H2O-24e-=6CO2+24H+ |
| C、今后的研究方向是怎样提高葡萄糖生物燃料电池的效率,从而达到可以利用葡萄糖生物燃料电池为任何可植入医疗设备提供电能 |
| D、该生物燃料电池可以在高温下工作 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com