
【题目】I.某实验小组用如图所示的实验装置验证S、C、Si三种元素的非金属性强弱。
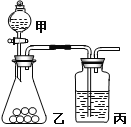
(1)仪器甲的名称为 ,甲中所盛试剂的化学式为 。
(2)乙中盛有白色粉末,可观察到的现象为 。
(3)丙中发生反应的离子方程式为 。
II.另一实验小组用该套装置验证氧化性 KMnO4>Cl2>I2 (已知高锰酸钾常温下可氧化浓盐酸生成氯气)。
(4)写出乙中发生反应的离子方程式: 。
(5)丙中盛有KI溶液和苯的混合物,丙中观察到的现象为 。
【答案】Ⅰ.(1)分液漏斗,H2SO4;(2)固体溶解,并产生大量气泡;(3)CO2+H2O+SiO32-=H2SiO3↓+CO32-;Ⅱ.(4)2MnO4-+10Cl-+16H+=5Cl2↑+8H2O+2Mn2+;(5)上层溶液变为紫红色。
【解析】试题分析:I.(1)仪器甲为分液漏斗,验证三者的非金属性,是验证三者最高价氧化物对应水化物的酸性,酸性越强,其非金属性越强,因此甲中盛放的是H2SO4;(2)固体溶解,产生大量的气泡;(3)丙中盛放的Na2SiO3溶液,因此有CO2+SiO32-+H2O=H2SiO3↓+CO32-;II.(4)利用高锰酸钾的强氧化性,根据信息,Mn的化合价由+7→+2,Cl由-1→0,根据化合价升降法,进行配平,离子反应方程式为2MnO4-+10Cl-+16H+=5Cl2↑+8H2O+2Mn2+;(5)Cl2+2I-=2Cl-+I2,利用I2易溶于有机溶剂,且苯的密度小于水,出现分层,且上层为紫红色。


科目:高中化学 来源: 题型:
【题目】“材料”的发现和使用往往会极大地推动生产、生活的发展,一些材料的出现甚至具有里程碑式的划时代的意义。请回答下列问题:
(1)无机非金属材料
高纯度单晶硅是典型的无机非金属材料,又称“半导体”材料,它的发现和使用曾引起计算机的一场“革命”。这种材料可以按下列方法制备:
![]()
①写出步骤Ⅰ的化学方程式:____________________________。
②步骤Ⅱ经过冷凝得到的SiHCl3(沸点为33.0 ℃)中含有少量的SiCl4(沸点为57.6 ℃)和HCl(沸点为-84.7 ℃),提纯SiHCl3的实验方法是____________________________。
(2)磁性材料
这种材料一般含有铁元素,铁是用途最为广泛的金属,也较为活泼,所以从它的使用开始就不断实施对它的防护。最常见的铁制品腐蚀是电化学腐蚀,请写出最为普遍的电化学腐蚀的负极反应式:____________________________。
(3)激光材料
我国是激光技术先进的国家,红宝石(Al2O3)是最早用于产生激光的材料,它是一种两性氧化物,请用离子方程式加以说明:______________________________。
(4)高分子材料
它可以分成无机高分子材料和有机高分子材料。一种新型高效净水剂[AlFe(OH)nCl6-n]m就属于无机高分子材料,它广泛应用于生活用水和工业污水的处理,其中铁元素的化合价为__________;一种合成纤维腈纶,又称“人造羊毛”,以丙烯腈(CH2===CH—CN)为原料聚合生成,请写出生成该有机高分子材料的化学方程式:________________________。
(5)合金材料
14 g铜银合金与一定量某浓度的硝酸完全反应后,将放出的气体与1.12 L(标准状况下)O2混合通入水中,恰好全部被水吸收,则合金中铜的质量为________ g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20 mL 0.2 mol /L H2A溶液中滴加0.2 mol /L NaOH溶液。有关微粒的物质的量变化如图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)所示。根据图示判断,下列说法正确的是
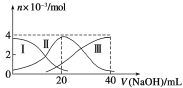
A.当V(NaOH)=20 mL时,溶液中离子浓度大小关系:c(Na+)>c(HA-)>c(A2-) >c(H+) >c(OH-)
B.等浓度的NaOH溶液与H2A溶液按2∶1混合后,其溶液中水的电离程度比纯水大
C.NaHA溶液中:c(OH-)=c(H+)+c(HA-)+2c(H2A)
D.向上述加入20 mL NaOH溶液后所得溶液中再加入水的过程中,pH可能减少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解9.6g。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如下图所示(己知硝酸只被还原为NO气体)。下列分析或结果错误的是
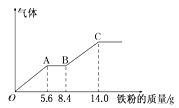
A. H2SO4浓度为2.5mol·L-1
B. OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生氢气
C. 第二份溶液中最终溶质为FeSO4
D. 原混合酸中NO3-的物质的量为0.1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在固定容积的密闭容器中,能表示反应X(g)+2Y(g)![]() 2Z(g)一定达到化学平衡状态的是
2Z(g)一定达到化学平衡状态的是
①X、Y、Z的物质的量之比为1∶2∶2
②X、Y、Z的浓度不再发生变化
③容器中气体的压强不再发生变化
④单位时间内生成n mol Z,同时生成n mol X
A. ①② B. ①④ C. ②③ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关非金属元素说法正确的是
A.二氧化氯具有还原性,可用于自来水的杀菌消毒
B.液氨汽化时要吸收大量的热,可用作制冷剂
C.硫具有还原性,可用硫粉覆盖地上洒落的汞
D.硅是重要的半导体材料,常用于制作光导纤维
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素Q、R、T、W在元素周期表中的位置如下图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
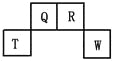
(1)W在周期表中的位置是 ,Q、R、T三种元素原子半径由大到小顺序为 (用元素符号表示),Q的最高价氧化物的电子式为 ,R氢化物分子的结构式为 。
(2)元素的原子得电子能力:Q W(填“强于”或“弱于”)。
(3)原子序数比R多1的元素有一种氢化物能分解为它的另一种氢化物,该反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应既属于氧化还原反应,又属于吸热反应的是( )
A.铝片与稀盐酸反应
B.甲烷在氧气中燃烧
C.灼热的炭与二氧化碳反应
D.Ba(OH)28H2O与NH4Cl反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色稀溶液X中,可能含有下表所列离子中的某几种。
![]()
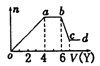
现取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂体积(V)的关系如图所示。
(1)若Y是盐酸,则oa段转化为沉淀的离子(指来源于X溶液的,下同)是_________,
ab段发生反应的离子是________,bc段发生反应的离子方程式为________。
(2)若Y是NaOH溶液,则X中一定含有的阳离子是______________,其物质的量之比为________,
ab段反应的离子方程式为_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com