
【题目】下面是某同学设计的用于鉴别苯和苯的同系物的几种方法或试剂,其中最适合的是( )
A. 液溴和铁粉B. 浓溴水
C. 酸性KMnO4溶液D. 在空气中点燃
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】海洋是个巨大的资源宝库,它不仅孕育着无数的生命,还蕴藏着丰富的矿产,海水中含有大量的化学物质,是宝贵的化学资源。海水素有“液体工业原料”的美誉,可从海水中提取大量的食盐、镁、溴、碘、钾等有用物质。下面是海水综合利用的部分流程:

完成下列问题:
(1)下列说法错误的是________(填标号)。
A.电解饱和食盐水时阳极的电极反应式为:Cl2+2e-===2Cl-
B.苦卤制溴过程一定发生氧化还原反应
C.操作Ⅰ是蒸发结晶
D.E物质可以循环使用
(2)沉淀剂A来源于石灰窑厂,写出A的化学式:A_______________。
(3)实验室提纯粗盐的实验操作依次为:取样、________、沉淀、过滤、________。
(4)工业生产纯碱的工艺流程中,碳酸化时产生的现象为___________,发生反应的化学方程式是____________,其原因是______________。
(5)碳酸化后过滤,滤液D最主要的成分是________(填写化学式),检验这一成分的阴离子的具体方法是___________。向滤液D中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用是________(填标号),这样做可使原料氯化钠的利用率从70%提高到90%以上。
a.增大NH![]() 的浓度,使NH4Cl更多地析出
的浓度,使NH4Cl更多地析出
b.使NaHCO3更多地析出
c.使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
(6)用加热分解的方法测定产品纯碱的纯度,若取m1 g纯碱样品,实验结束后称得固体质量为m2 g,则纯碱的纯度为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第 VIII 族元素,跟主族元素的金属相比,它们有熔、沸点高、硬度高、密度大等特点,并有良好的延展性和高导电、导热性。下列有关它们及其化合物的结构与性质,请填写:
(1)在[Ni(NH3)6]2+中,Ni2+与NH3之间形成的化学键称为________,提供孤对电子的成键原子是________。
(2)①Co元素形成CoCl3·4NH3(绿色)和CoCl3·4NH3(紫色)各1mol,分别与足量硝酸银溶液反应,都得到1molAgCl沉淀。两种配合物中配合离子的配位数都是________,CoCl3·4NH3(绿色)和CoCl3·4NH3(紫色)的组成相同而颜色不同的原因是________。
②Co(OH)2为两性氢氧化物,在浓的强碱溶液中可以形成[Co(OH)4]2。写出Co(OH)2酸式电离的电离方程式__________。
(3)与 Co 属于同周期同族的过渡元素A,其基态原子排布中有四个未成对电子。
①由此元素可构成固体X,区别X为晶体或非晶体的方法为______________。
②A可与CO反应生成A(CO) 5 ,常压下熔点为-20.3℃,沸点为103.6℃,该晶体类型是______________。
③A3+与SCN不仅能以1:3的个数比配合,还可以其它个数比配合。若 A3+与SCN以1:4 的个数比配合,则ACl3与KSCN在水溶液中发生反应的化学方程式可表示为_______。
④A 可与另两种元素B、C构成某种化合物,B、C的外围电子排布分别为3d104s1、3s23p4,其晶胞如图所示,则其化学式为_________。
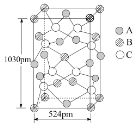
该晶胞上下底面为正方形,侧面与底面垂直,根据图中所示的数据列式计算该晶体的密度d=__________g﹒cm3。(保留两位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
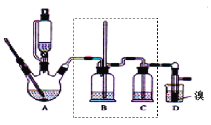
【题目】实验室制备1,2-二溴乙烷,可用足量的乙醇先制备乙烯,再用乙烯和少量的溴制备1,2-二溴乙烷,装置如下图所示:
有关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g·cm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -130 | 9 | -116 |
回答下列问题:
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是____;(填正确选项前的字母)
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置A中除了浓硫酸和乙醇外,还应加入___,其目的是_____,装置A中生成副产物乙醚的化学反应方程式 ______。
(3)实验室制取乙烯,常因温度过高而使乙醇和浓H2SO4反应生成少量的二氧化硫,为了验证二氧化硫的存在并除去二氧化硫对后续反应的干扰,某同学在A和D之间加入了B、C两个装置,其中B和C中可分别盛放_____
a.酸性KMnO4和水 b.品红和NaOH溶液
c.酸性KMnO4和NaOH溶液 d.品红和酸性KMnO4
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在____层(填“上”、“下”);若产物中有少量副产物乙醚。可用_____的方法除去。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酰氯(SO2Cl2)熔点-54.1℃、沸点69.2℃,在染料、药品、除草剂和农用杀虫剂的生产过程中有重要作用。
(1)SO2Cl2中S的化合价为___________,SO2Cl2在潮湿空气中因水解“发烟”的化学方程式为__________。
(2)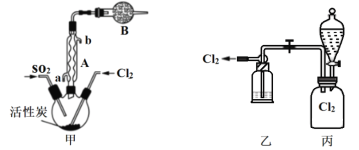
①仪器A的名称为___________,装置B的作用是____________。
②装置乙中装入的试剂是浓硫酸,装置丙分液漏斗中盛装的最佳试剂是________(选填字母)。
A.蒸馏水 B.10.0 molL1浓盐酸 C.浓氢氧化钠溶液 D.饱和食盐水
③滴定法测定硫酰氯的纯度:取1.800g产品,加入到100mL 0.5000mol·L1 NaOH溶液中加热充分水解,冷却后加蒸馏水准确稀释至250mL,取25mL溶液于锥形瓶中,滴加2滴甲基橙,用0.1000mol·L1标准HCl滴定至终点,重复实验三次取平均值,消耗10.00mL滴定终点的判断为___________,产品的纯度为_________。
(3)探究硫酰氯在催化剂作用下加热分解的产物,实验装置如图所示(部分夹持装置未画出)。

①加热时A中试管出现黄绿色,装置B的作用是_________。
②装置C中反应的离子方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.下表是元素周期表的一部分,针对表中的①~⑩种元素,填写下列空白:
主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0族 |
第二周期 | ① | ② | ③ | |||||
第三周期 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
第四周期 | ⑨ | ⑩ |
(1)在这些元素中,化学性质最不活泼的是:________(填元素符号),
(2)在最高价氧化物对应的水化物中,碱性最强的化合物是________(填化学式),在常温下该化合物和元素⑦的单质反应的离子方程式__________。
(3)用电子式表示元素④与⑥的化合物的形成过程:__________。
(4)表示①与⑦的化合物的电子式_______,该化合物是由______(填“极性”或“非极性”)键形成的。
(5)③、⑥、⑦三种元素形成的离子,离子半径由大到小的顺序是____________(用化学式表示)。
II.①CBr2;②H2O;③NH4Cl;④H2O2;⑤Na2O2;⑥Ca(OH)2;⑦HClO;⑧I2;⑨He
只含有离子键的是(用序号回答)_____,即含离子键又含共价键是(用序号回答)_____,其中含有非极性共价键的共价化合物是(用序号回答)_____,常温时为固体,当其熔化时,不破坏化学键的是(用序号回答)_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用苯和浓硝酸、浓硫酸发生反应制取硝基苯的装置如图所示。回答下列问题:
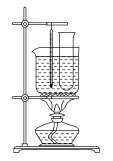
(1)反应需在50~60 ℃的温度下进行,图中给反应物加热方法是____。它的优点是___和_____
(2)在配制混合酸时应将________加入________中。
(3)该反应的化学方程式是_____________。
(4)由于装置的缺陷,该实验可能导致的不良后果是________
(5)反应完毕后,除去混合酸,所得粗产品用如下操作精制:①蒸馏 ②水洗 ③用干燥剂干燥 ④10% NaOH溶液洗 ⑤水洗,其中正确的操作顺序是________。
A.①②③④⑤ B.②④⑤③①
C.④②③①⑤ D.②④①⑤③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CoCO3可用作选矿剂、催化剂及家装涂料的颜料。以含钴废渣(主要成CoO、Co2O3,还含有Al2O3、ZnO等杂质)为原料制备CoCO3的一种工艺流程如下:
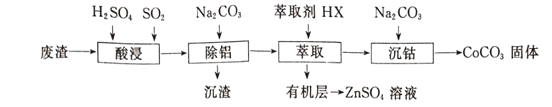
下表是相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol/L计算):
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
Co2+ | 7.6 | 9.4 |
Al3+ | 3.0 | 5.0 |
Zn2+ | 5.4 | 8.0 |
(1)写出“酸溶”时发生氧化还原反应的化学方程式____________________。
(2)“除铝”过程中需要调节溶液pH的范围为_______________ 。
(3)在实验室里,萃取操作用到的玻璃仪器主要有____;上述“萃取”过程可表示为ZnSO4(水层)+2HX(有机层) ![]() ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是______。
ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是______。
(4)简述洗涤沉淀的操作____________________________________。
(5)在空气中煅烧CoCO3生成钴氧化物和CO2,测得充分煅烧后固体质量为2.41g,CO2的体积为0.672L(标准状况),则该钴氧化物的化学式为 ____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积固定容器中,发生反应2HI(g)![]() H2(g)+I2(g), 下列方法中能证明已达到平衡状态的是( )
H2(g)+I2(g), 下列方法中能证明已达到平衡状态的是( )
①混合气体的颜色不再变化 ②![]() 各组分浓度相等 ③
各组分浓度相等 ③![]()
④一个H-H键断裂的同时有两个H-I键断裂 ⑤混合气体的平均摩尔质量不再变化
A. ①④ B. ①②④ C. ①③⑤ D. ①④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com