
 ,Q3Y2与水可剧烈反应,产生沉淀与气体,反应的化学方程式为Mg3N2+6H2O=3Mg(OH)2+2NH3↑.
,Q3Y2与水可剧烈反应,产生沉淀与气体,反应的化学方程式为Mg3N2+6H2O=3Mg(OH)2+2NH3↑.分析 X、Y、Z、R、Q、M是六种短周期元素,原子序数依次增大.X是原子半径最小的元素,故X为H元素;Y的气态氢化物能使湿润的红色石蕊试纸变蓝,故为氨气,则Y为N元素;Z为地壳中含量最多的元素,故为O元素;R与X同主族,且原子序数大于8,故为Na元素;Y、R、Q最外层电子数之和为8,故Q的最外层有2个电子,且原子序数比11大;M的单质黄绿色有害气体,故为Cl元素.
(1)R为Na元素;
(2)微粒的电子层数越多,则半径越大;当电子层数相同时,核电荷数越多,则半径越小;
(3)X、Y、Z三种元素形成盐类化合物为NH4NO3,NH4+水解显酸性,据此分析离子浓度大小;
(4)YX4M为NH4Cl,为离子化合物;Q3Y2为Mg2N3,在水溶液中发生双水解;
(5)X、Z两元素形成的原子个数比为1:1的化合物为H2O2;
(6)M的单质即为氯气,与R的最高价氧化物对应的水化物即为NaOH反应,生成氯化钠、次氯酸钠和水,据此写出离子方程式.
解答 解:X、Y、Z、R、Q、M是六种短周期元素,原子序数依次增大.X是原子半径最小的元素,故X为H元素;Y的气态氢化物能使湿润的红色石蕊试纸变蓝,故为氨气,则Y为N元素;Z为地壳中含量最多的元素,故为O元素;R与X同主族,且原子序数大于8,故R为Na元素;Y、R、Q最外层电子数之和为8,故Q的最外层有2个电子,且原子序数比11大,故为Mg元素;M的单质黄绿色有害气体,故为Cl元素.
(1)R为Na元素,在周期表中处于第三周期第IA族,故答案为:第三周期第IA族;
(2)Z、Q、M简单离子分别为O2-、Mg2+、Cl-,而微粒的电子层数越多,则半径越大,故Cl-的半径最大;当电子层数相同时,核电荷数越多,则半径越小,故Mg2+的半径最小,故简单离子半径由大到小的顺序为Cl->O2->Mg2+,故答案为:Cl->O2->Mg2+;
(3)X、Y、Z三种元素形成盐类化合物为NH4NO3,NH4+水解显酸性:NH4++H2O?NH3•H2O+H+,由于NH4+水解,且溶液显酸性,故离子浓度大小为:c(NO3-)>c(NH4+)>c(H+)>c(OH-),故答案为:NH4++H2O?NH3•H2O+H+;c(NO3-)>c(NH4+)>c(H+)>c(OH-);
(4)YX4M为NH4Cl,为离子化合物,电子式为: ;Q3Y2为Mg2N3,在水溶液中发生双水解生成氢氧化镁和氨气,反应的化学方程式为:Mg3N2+6H2O=3Mg(OH)2+2NH3↑;
;Q3Y2为Mg2N3,在水溶液中发生双水解生成氢氧化镁和氨气,反应的化学方程式为:Mg3N2+6H2O=3Mg(OH)2+2NH3↑;
;故答案为: ;Mg3N2+6H2O=3Mg(OH)2+2NH3↑;
;Mg3N2+6H2O=3Mg(OH)2+2NH3↑;
(5)X、Z两元素形成的原子个数比为1:1的化合物为H2O2,为共价化合物,只含共价键,故答案为:共价键;
(6)M的单质即为氯气,与R的最高价氧化物对应的水化物即为NaOH反应,生成氯化钠、次氯酸钠和水,离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O,故答案为:Cl2+2OH-=Cl-+ClO-+H2O.
点评 本题考查了元素的推断、离子方程式书写方法和物质性质的理解应用,主要是盐水解过程和氮化物与水反应的应用,掌握基础是关键,题目较简单.


 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:解答题
| 相对分子质量 | 熔点/℃ | 沸点/℃ | 溶解性 | |
| 甲苯 | 92 | -94.9 | 110.6 | 难溶于水 |
| 苯甲酸 | 122 | 122.13 | 249 | 微溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等物质的量的硫蒸气和硫固体分别完全燃烧,前者放出热量多 | |
| B. | 已知H2(g)+Cl2(g)═2HCl(g)△H=-184.6kJ•mol-1,则有反应HCl(g)═$\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)△H=+92.3kJ•mol-1 | |
| C. | 稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1,则将含0.5mol H2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量等于57.3kJ | |
| D. | 已知氧气较臭氧稳定,则3O2(g)═2O3(g)△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

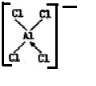 ,[AlCl4]的立体构型名称为正四面体形.
,[AlCl4]的立体构型名称为正四面体形.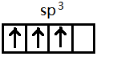 ,铍与铝元素性质相近的原因是Be与Al的电负性相近.
,铍与铝元素性质相近的原因是Be与Al的电负性相近.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲醇是一种可再生的绿色能源,CO2是一种温室气体,它们都是重要的化工原料.
甲醇是一种可再生的绿色能源,CO2是一种温室气体,它们都是重要的化工原料.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KSCN溶液和氯水 | B. | 铁粉和KSCN溶液 | C. | 浓氨水 | D. | 酸性KMnO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
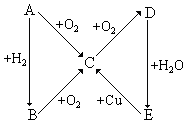 根据如图所示的A、B、C、D、E五种物质的相互转化关系,按如下要求填写相应的物质和有关反应的化学方程式.
根据如图所示的A、B、C、D、E五种物质的相互转化关系,按如下要求填写相应的物质和有关反应的化学方程式.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
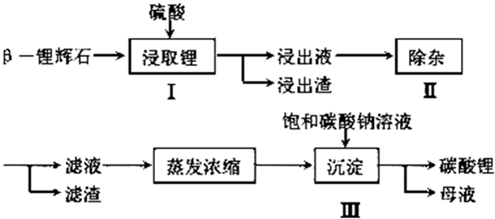
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com