
【题目】[化学—选修2:化学与技术]
信息时代给人们的生活带来了极大的便利,但同时也产生了大量的电子垃圾。某化学兴趣小组将一批废弃的线路板简单处理后,得到了主要含Cu、Al及少量Fe、Au等金属的混合物,并设计了如下制备硫酸铜晶体和硫酸铝晶体的路线:

部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:

(1)过滤操作中用到的玻璃仪器有___________。
(2)Cu可溶于稀硫酸与H2O2的混合溶液,其离子方程式是____________。
(3)滤渣a的主要成分是_________________。
(4)步骤③中X的取值范围是____________________。
(5)为了测定硫酸铜晶体的纯度,该组甲同学准确称取4.0g样品溶于水配成100mL溶液,取10mL溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI和淀粉指示剂,用0.1000 mol·L-1Na2S2O3标准溶液滴定至终点。共消耗14.00mLNa2S2O3标准溶液。上述过程中反应的离子方程式如下:
2Cu2++4I-=2CuI(白色)↓+I2 2S2O32-+I2=2I-+S4O62-
①样品中硫酸铜晶体的质量分数为____________。
②该组乙同学提出通过直接测定样品中SO42-的量也可求得硫酸铜晶体的纯度,老师审核后予以否决,其原因是______________。
(6)请你设计一个由滤渣c得到Al2(SO4)3·18H2O的实验方案___________。
【答案】(1)漏斗、烧杯、玻璃棒;
(2)Cu+H2O2+2H+=Cu2++2H2O;(3)Au;
(4)5.2≤X<5.4;(5)①87.5%;②样品中的杂质Na2SO4中也含有SO42-;
(6)将滤渣c加入稀硫酸溶解,然后蒸发、浓缩、冷却、结晶、过滤得到晶体
【解析】
试题分析:由流程可知,金属混合物加入稀硫酸铝、铁溶解,加入过氧化氢,亚铁离子被氧化为铁离子,铜在酸性溶液中被过氧化氢氧化为铜离子,过滤得到滤渣a为Au,滤液中主要含有铁离子、铝离子和铜离子,加入氢氧化钠溶液调节溶液pH=3.4,依据题干信息,是为了沉淀铁离子,过滤得到滤渣b为Fe(OH)3,滤液为铝离子和铜离子,加入氢氧化钠溶液调节溶液pH=5.2~5.4使铝离子全部沉淀过滤得到滤渣C为Al(OH)3,用硫酸溶解后蒸发、浓缩、冷却、结晶、过滤得到Al2(SO4)218H2O晶体;得到滤液为硫酸铜溶液,通过蒸发浓缩,冷却结晶,过滤洗涤得到硫酸铜晶体;
(1)过滤是化学实验中经常用到的实验操作.过滤操作中用到的玻璃仪器有烧杯、玻璃棒、漏斗;
(2)Cu可溶于稀硫酸与H2O2的混合溶液,铜被氧化成铜离子,双氧水生成水,根据化合价升降相等配平,反应的离子方程式是Cu+H2O2+2H+=Cu2++2H2O;
(3)由于Cu、Al、Fe都因反应溶解于溶液中,剩下Au不反应,过滤到了滤渣a中;
(4)加入氢氧化钠溶液调节pH=x,目的是生成氢氧化铝沉淀,氢氧化铝开始沉淀pH=4,沉淀完全pH=5.2,氢氧化铜开始沉淀pH=5.4,所以选择的pH范围是:5.2≤X<5.4;
(5)由2Cu2++4I-=2CuI(白色)↓+I2、2S2O32-+I2=2I-+S4O62-可知, 反应的定量关系为:
2Cu2+~I2 ~2S2O32-
1.4×10-3mol 0.100 0molL-1×0.014.00L=1.4×10-3mol
100ml溶液中含硫酸铜晶体物质的量为1.4×10-2mol,所以硫酸铜晶体的质量分数 = ![]() × 100% = 87.5%;
× 100% = 87.5%;
②依据流程分析判断,样品中含有硫酸钠,不能通过测定硫酸根离子的方法计算得到硫酸铜晶体的质量分数;
(6)分析流程可知,滤渣C主要是氢氧铝,加入硫酸溶解后通过蒸发浓缩,冷却结晶,过滤洗涤得到晶体Al2(SO4)318H2O。


科目:高中化学 来源: 题型:
【题目】下表是元素周期表一部分,列出了十个元素在周期表中的位置:
族 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | ⑥ | |||||||
3 | ① | ③ | ⑤ | ⑦ | ⑧ | ⑩ | ||
4 | ② | ④ | ⑨ |
请用化学用语回答下列问题
(1)在①~⑦元素中,原子半径最大的是 (填元素符号);
(2)①~⑩中元素最高价氧化物对应的水化物中酸性最强的是 (填物质化学式),⑤所对应元素的单质工业制备方法为 。
(3)用电子式表示元素③与⑧形成化合物的过程 。
(4)我国首创以单质⑤—空气—海水电池作为能源的新型的海水标志灯,以海水为电解质溶液,靠空气中的氧气使单质⑤不断氧化而产生电流,只要把灯放入海水数分钟,就会发出耀眼的白光。则电源的负极反应是 ,正极反应为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年8月12日,天津滨海新区爆炸事故确认有氰化钠(NaCN)、亚硝酸钠等,氰化钠毒性很强,遇水、酸会产生有毒易燃氰化氢气体。氰化氢的沸点只有26摄氏度,因此相当容易挥发进入空气,这就大大增加了中毒的风险。同时氰化钠遇到亚硝酸钠会发生爆炸。回答下列问题
(1)写出氰化钠遇水产生氰化氢的离子方程式 。
(2)爆炸现场约700吨的氰化钠大约需要900吨的双氧水来处理。氰化钠与双氧水相遇后,会释放出氨气同时析出白色晶体,使得氰化钠的毒性大大降低,写出氰化钠与双氧水反应的化学方程式 。
(3)氰化钠遇到亚硝酸钠能生成两种气体发生爆炸,写出化学反应方程式 。
(4)爆炸残留在废水中的CN- 可以用Cr2O72-处理,拟定下列流程进行废水处理,
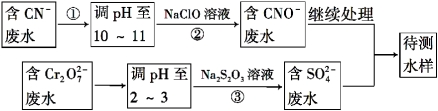
1)上述处理废水流程中主要使用的方法是 ;
A.混凝法 B.中和法 C.沉淀法 D.氧化还原法
2)②中反应后无气体放出,该反应的离子方程式为_______________________;
3)步骤③中,每处理0.4 mol Cr2O72 - 时转移电子2.4 mol,该反应的离子方程式为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.下列七种有机物中:①CH4 ②CH2=CH2 ③![]() ④CH3COOH ⑤HOCH2CHO ⑥CH3CH2CH2CH3 ⑦葡萄糖 ⑧蛋白质 ⑨淀粉
④CH3COOH ⑤HOCH2CHO ⑥CH3CH2CH2CH3 ⑦葡萄糖 ⑧蛋白质 ⑨淀粉
(1)可与浓硝酸发生颜色反应的是______________(填序号,下同)。
(2)属于同系物的是__________
(3)互为同分异构体的是___________。.
(4)易发生银镜反应的是______________
II.在5L的密闭容器中充入1mol A 和2mol B,在一定条件下发生反应4A(g)+5B(g)![]() 4C(g)+6D(g),半分钟后,C的物质的量增加了0.30mol.
4C(g)+6D(g),半分钟后,C的物质的量增加了0.30mol.
(5)D的平均反应速率为 .
(6)A的转化率为
(7) 不能判断该反应已达平衡状态的是
A 单位时间内生成n mol A的同时生成2n mol D的状态
B 生成物浓度不再变化的状态 .
C 混合气体的平均相对分子质量不再改变的状态.
D 混合气体的压强不再改变的状态
E 容器中各组分的体积分数不随时间变化的状态
F 容器中A、B、C、D的物质的量的比一定是4:5:4:6的状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,向A中充入1mol X和1mol Y,向B中充入2mol X和2mol Y,起始时,V(A)=V(B)=a L.在相同温度和有催化剂存在的条件下,两容器中各自发生下述反应:X(g)+Y(g)2Z(g)+W(g)△H<0
达到平衡时,V(A)=1.2aL.试回答:
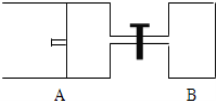
(1)A中X的转化率α(X)= 。
(2)A、B中X转化率的关系:α(A) α(B)(填“>”“=”或“<”)。
(3)平衡时的压强:P(B) 2P(A)(填“>”“=”或“<”)。
(4)打开K,一段时间又达平衡时,A的体积为 L(连通管中气体体积不计)。
(5)在(3)达平衡后,同时等幅升高A、B的温度,达新平衡后A的体积 (填“变大”“不变”或“变小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种离子晶体的晶胞如图其中阳离子A以![]() ,表示阴离子B以
,表示阴离子B以![]() 表示。
表示。
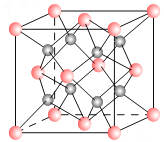
(1)若A和B的核外电子排布与Ar相同,则该离子化合物的化学式是 ___________________;
(2)阳离子周围距离最近的阴离子数为___ __,阴离子周围距离最近的阴离子数___ __。
(3)若与MgO的熔点比较,出现不同的原因是
(4)已知A的离子半径为r m,则该晶胞的体积是 ___________m3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】低碳经济是以低能耗、低污染、低排放为基础的经济模式,低碳循环正成为科学家研究 的主要课题。最近有科学家提出构想:把空气吹 入饱和碳酸钾溶液,然后再把CO2从溶液中提取 出来,经化学反应后使之变为可再生燃料甲醇。 该构想技术流程如下:
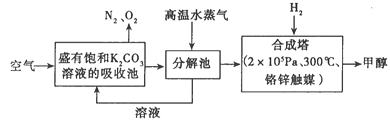
(1)向分解池中通入高温水蒸气的作用是________________。
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) △H=-1275.6 kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) △H=-566.0 kJ·mol-1
③H2O(g)=H2O(l) △H=-44.0 kJ·mol-1
则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为______________。
(3)依据甲醇燃烧的反应原理。设计如右图所示的电池装置。该装置负极的电极反应式为____________。
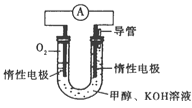
(4)已知Ksp(CaCO3)=2.8×10-9mol2·L-2.现将CaCl2溶液与0.02 mol·L-1Na2CO3溶液等体积混合,生成CaCO3沉淀时,所需CaCl2溶液的最小物质的量浓度为_____________。
(5)CO(g)和H2O(g)在一定条件下反应可得到清洁燃料H2。将不同量的CO(g)和H2O(g)分别通入到体积为2 L的恒容密闭容器中发生反应:CO(g)+H2O(g)=CO2(g)+H2(g),不同温度下得到三组数据:
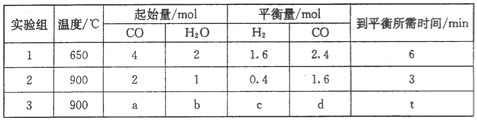
①实验1前6 min的反应速率v(CO2)=___________(保留小数点后两位,下同)。
②实验2条件下平衡常数K=_____________。
③该反应的△H____________0 (填“<”或“>”=。)
④实验3中,若平衡时的转化率α(CO)>α(H2O),则a/b的取值范围是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t℃时Ag2CrO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )
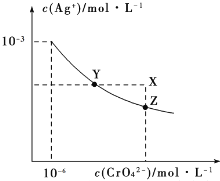
A.加热蒸发饱和Ag2CrO4溶液再恢复到t℃,可使溶液由Y点变到Z点
B.在X点没有Ag2CrO4沉淀生成,则此时温度低于t℃
C.向饱和Ag2CrO4溶液中加入少量AgNO3固体,可使溶液由Z点到Y点
D.在t℃时,Ag2CrO4的Ksp为1×10-9
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com