
| A、N | B、M | C、X | D、Y |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
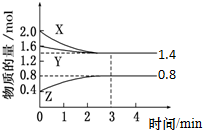 t℃时,在容积为2L密闭中充入X(g)、Y(g)与Z(g),反应过程中X、Y、Z的物质的量变化如下图所示.下列说法不正确的是( )
t℃时,在容积为2L密闭中充入X(g)、Y(g)与Z(g),反应过程中X、Y、Z的物质的量变化如下图所示.下列说法不正确的是( )| A、0~3 min,X的平均反应速率v(X)=0.1 mol?L-1?min-1 |
| B、发生反应的方程式可表示为:3 X(g)+Y(g)?2 Z(g) |
| C、3 min 时,Y的转化率为12.5%,此时,充入惰性气体Ne,转化率不变 |
| D、温度不变,增大Z的浓度,该反应的平衡常数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
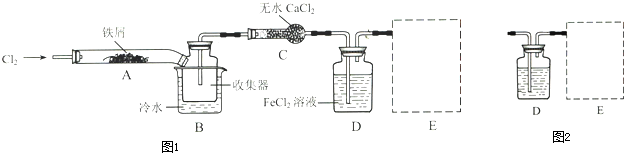
 氯气是一种重要的化工原料.如图为实验室制取氯气的装置.请回答:
氯气是一种重要的化工原料.如图为实验室制取氯气的装置.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 甲醛是一种重要的有机原料,主要用于塑料工业、医药等.工业上可用如下方法合成甲醛:CO(g)+H2(g)?HCHO(g)△H<0.如图为一定条件下,上述反应的变化状况.
甲醛是一种重要的有机原料,主要用于塑料工业、医药等.工业上可用如下方法合成甲醛:CO(g)+H2(g)?HCHO(g)△H<0.如图为一定条件下,上述反应的变化状况.查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | D |
 | 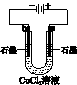 |  |  |
| 盐桥中的Cl-移向ZnSO4溶液 | a极附近产生的气体能使湿润的淀粉碘化钾试纸变蓝 | 粗铜的电极反应式为: Cu2++2e-=Cu | 正极反应式为: O2+4e-+2H2O=4OH- |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
 2007年诺贝尔化学奖授予善于做“表面文章”的德国科学家格哈德?埃特尔.他的成就之一是证实了气体在固体催化剂表面进行的反应,开创了表面化学的方法论.在汽车尾气净化装置里,气体在催化剂表面吸附与解吸作用的过程如图所示.下列说法正确的是( )
2007年诺贝尔化学奖授予善于做“表面文章”的德国科学家格哈德?埃特尔.他的成就之一是证实了气体在固体催化剂表面进行的反应,开创了表面化学的方法论.在汽车尾气净化装置里,气体在催化剂表面吸附与解吸作用的过程如图所示.下列说法正确的是( )| A、NO2是该过程的中间产物 |
| B、NO和O2必须在催化剂表面才能反应催化剂 |
| C、汽车尾气的主要污染成分是CO2和NO |
| D、该催化转化的总反应方程式为:2NO+O2+4CO═4CO2+N2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、四氧化三铁溶于稀硝酸中:Fe3O4+8H+=2Fe3++Fe2++4H2O | ||||
B、用铁电极电解饱和食盐水:2 C1?+2H2O
| ||||
C、Na2O2固体投入H
| ||||
| D、等体积、等浓度的Ba(OH)2溶液与NH4HCO3溶液混合:Ba2++2OH-+NH4++HCO3-═BaCO3↓+H2O+NH3?H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com