
| A. | Ba2+、OH-、NO${\;}_{3}^{-}$、Na+ | B. | K+、Cu2+、SO42-、Cl- | ||
| C. | Na+、K+、HCO3-、SO42- | D. | Mg2+、SO42-、Na+、NO3- |
 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | c(Na+)>c(HS-)>c(OH-)>c (H2S) | B. | c (Na+)+c (H+)=c (S2-)+c (OH-)+c (HS-) | ||
| C. | 2c (Na+)=c (S2-)+c (H2S)+c (HS-) | D. | c(Na+)>c(S2-)>c(OH-)>c (H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2、SO2均能使品红溶液褪色,说明二者均有氧化性 | |
| B. | 分别充满HCl、NH3的烧瓶倒置于水中后液面均迅速上升,说明二者均易溶于水 | |
| C. | Fe与稀HNO3溶液、稀H2SO4溶液反应均有气泡产生,说明两反应均为置换反应 | |
| D. | 加热分别盛有氯化铵和碘的两支试管,试管底部固体均减少,说明二者均发生升华 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向某溶液中滴入KSCN溶液呈红色,说明不含Fe2+ | |
| B. | 向某溶液中加入酸性KMnO4溶液,溶液褪色,说明原溶液中一定含Fe2+ | |
| C. | 向某溶液中加入NaOH溶液,得红褐色沉淀,说明溶液中含有Fe3+ | |
| D. | 向某溶液中加入NaOH溶液得白色沉淀,又观察到颜色逐渐变为红褐色,说明该溶液中含有Fe2+,可能含有Mg2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 洗涤沉淀时,应用玻璃棒轻轻搅拌,使得沉淀表面上的杂质溶于水中 | |
| B. | 将两块未擦去氧化膜的铝片分别投入1mol?L-1CuSO4溶液、1mol?L-1CuCl2溶液中,一段时间后,铝片表面都观察不到明显的反应现象 | |
| C. | 由锌、铜、稀硫酸构成的原电池溶液中加入适量的H2O2能提高电池的放电效率 | |
| D. | 在淀粉溶液中加入适量稀硫酸微热,再加少量新制氢氧化铜浊液加热,若无砖红色沉淀产生,则淀粉未发生水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
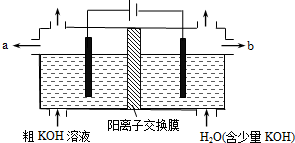 ( )
( )| A. | 阳极反应式为4OH--4e-=2H2O+O2↑ | B. | 通电后阴极区附近溶液pH会增大 | ||
| C. | K+通过交换膜从阴极区移向阳极区 | D. | 纯净的KOH溶液从b出口导出 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 沉淀物 | Fe(OH)3 | Zn(OH)2 |
| pH | 1.5-3.2 | 6.4-8.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去CuSO4溶液中的Fe(SO4)3,加入足量CuO粉末,充分搅拌过滤 | |
| B. | 烧碱、小苏打、氢氧化铝均可用于治疗胃酸过多 | |
| C. | 工业生产中,常将氯气通入澄清石灰水中,制取漂白粉 | |
| D. | 铁管道与直流电源正极相连,可缓解管道腐蚀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com