
| c(H+) |
| c(OH-) |
| c(H+) |
| c(HA) |
| c(HA) |
| c(A) |
| c(H+) |
| c(OH-) |
| c(H+) |
| c(OH-) |
| c(H+) |
| c(HA) |
| c(HA) |
| c(A-) |


 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:

| A、A气体是NH3,B气体是CO2 |
| B、把纯碱及第Ⅲ步所得晶体与某些固体酸性物质(如酒石酸)混合可制泡腾片 |
| C、第Ⅲ步操作用到的主要玻璃仪器是烧杯、漏斗、玻璃棒 |
| D、第Ⅳ步操作是将晶体溶于水后加热、蒸发、结晶 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、植物油的不饱和程度高于动物油,植物油更易氧化变质 |
| B、除去乙酸乙酯中少量的乙酸:用饱和碳酸钠溶液洗涤、分液 |
| C、过氧化钠中含有离子键和非极性共价键,阴离子与阳离子的物质的量之比为1:1 |
| D、向某溶液中滴入稀盐酸产生使澄清石灰水变浑浊的气体,该溶液不一定含有CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、相同温度下,饱和溶液中的Ag+浓度:AgCl>Ag2CrO4>AgI |
| B、向饱和食盐水中加AgNO3,形成AgCl沉淀时,溶液中的Ag+浓度为1.34×10-5 mol?L-1 |
| C、向含AgI难溶物的溶液中,逐滴加入饱和食盐水,原难溶物会变成白色 |
| D、向含Cl-、I-和CrO42-浓度均为0.010 mol?L-1的溶液中,逐滴加入AgNO3溶液,最先形成Ag2CrO4沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液中导电粒子的数目减少? | ||
| B、醋酸的电离程度增大,c(H+)亦增大 | ||
C、溶液中
| ||
| D、再加入10 mL pH=ll的NaOH溶液,混合液的PH=7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
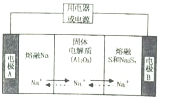 金属及其化合物在国民经济发展中起着重要作用
金属及其化合物在国民经济发展中起着重要作用| 物质 | Na | s | Al2O3 |
| 熔点/℃ | 97.8 | 115 | 2050 |
| 沸点/℃ | 892 | 444.6 | 2980 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、含Na+数目为
| ||
B、含氧原子数目为
| ||
C、完全氧化SO32-时转移电子数目为
| ||
D、含结晶水分子数目为
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com