
| A. | 丙烷分子中三个碳原子共平面 | B. | 丁烷的一氯代物共有4种 | ||
| C. | 正丁烷的4个碳原子在一直线上 | D. | CnH2n+2的烃中含有3n+1个共价键 |
分析 A.碳原子形成的4条价键的空间构型为四面体,丙烷分子中碳原子一定在同一平面上;
B.丁烷的一氯代物有4种,正丁烷有2种,异丁烷有2种;
C.根据烷烃分子中有多个碳原子,其结构为锯齿形判断正丁烷四个碳原子是否共线;
D.烷烃是饱和链烃,烷烃的通式为CnH2n+2,碳原子间以单键连接,碳原子形成四个化学键.
解答 解:A.丙烷分子中含有3个碳原子,碳原子形成的4条价键的空间构型为四面体,故丙烷中的3个碳原子处于四面体的一个平面上,故A正确;
B.丁烷的分子式为:C4H10,丁烷有2种同分异构体:正丁烷和异丁烷,正丁烷有2种氢原子,异丁烷有2种氢原子,所以一氯代物的数目为4,故B正确;
C.烷烃分子中有多个碳原子呈锯齿形连接,正丁烷四个碳原子一定不在一条直线上,故C错误;
D.烷烃是饱和链烃,碳原子间以单键连接,碳原子形成四个化学键分析判断,烷烃的通式是:CnH2n+2,含有碳碳单键数为n-1,含有碳氢单键数为2n+2,所以共价键个数为n-1+2n+2=3n+1,故D正确;
故选C.
点评 本题考查了烷烃的结构和性质,注意烷烃分子中碳原子形成四个单键,判断丁烷的一氯代物,先判断丁烷是否有同分异构体,再确定一氯代物的种类,题目难度不大.


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案科目:高中化学 来源: 题型:选择题
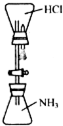 某同学受喷泉实验原理的启发,设计如图所示装置进行“喷烟”实验.下列对实验的有关说法错误的是( )
某同学受喷泉实验原理的启发,设计如图所示装置进行“喷烟”实验.下列对实验的有关说法错误的是( )| A. | 由于NH3的密度比HCl小,实验中二者的位置不能调换 | |
| B. | “白烟”是由于生成NH4Cl固体小颗粒的缘故 | |
| C. | 若用HBr代替HCl进行相同的操作,可得到相同的现象 | |
| D. | 实验时,打开活塞并挤出胶头滴管中的水即可看到白烟 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 是否是大量分子或离子的集合体 | B. | 是否均一、透明、稳定 | ||
| C. | 是否能透过滤纸或半透膜 | D. | 分散质微粒直径大小 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用铁触媒,加快合成氨反应速率 | B. | 过量空气有利于SO2转化为SO3 | ||
| C. | 打开汽水瓶盖,即有大量气泡逸出 | D. | 配置FeCl3溶液时,加入少量盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,A或B可以与水发生反应 | |
| B. | A与B用导线连接插入稀HNO3中,则形成原电池且B极上有H2放出 | |
| C. | A与B用导线连接插入B(NO3)2中,B极发生的电极反应式可能为:B2++2e-═B | |
| D. | 电解A(NO3)2与B(NO3)2的混合液,在阳极先析出B(使用碳电极) |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
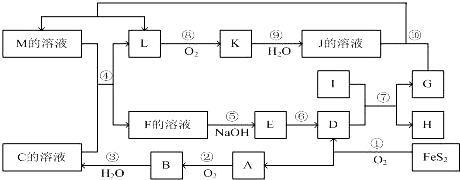
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com