
(1)��4molSO2��2molO2����2L���ܱ������У���һ�������·�����Ӧ����10s��ﵽƽ�⣬���SO3 ��Ũ��Ϊ0.6mol��L��1����ش��������⣺
��Ũ��Ϊ0.6mol��L��1����ش��������⣺
����O2��ʾ�ķ�Ӧ��ƽ������Ϊ_____________________________________
��ƽ��ʱSO2��ת����______________________________________
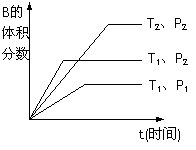 (2)��֪ij���淴ӦmA(g)��nB(g)
(2)��֪ij���淴ӦmA(g)��nB(g)  qC(g)���ܱ������н��С�
qC(g)���ܱ������н��С�
��ͼ��ʾ��Ӧ�ڲ�ͬʱ��t���¶�T��ѹǿP�뷴Ӧ��B�����
�����Ĺ�ϵ���ߡ�����ͼ�����
�ٻ�ѧ�������Ĺ�ϵ:m��n______q��(�����.������������
�ڸ÷�Ӧ������ӦΪ___________��Ӧ��������ȡ����ȡ���
(3)��FeCl3+3KSCN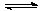 Fe(SCN)3+3KCl��ƽ����ϵ�У��ش��������⣺
Fe(SCN)3+3KCl��ƽ����ϵ�У��ش��������⣺
���������������������
������Һ�м���������KSCN���壬ƽ�� ______________�ƶ���
������Һ�м���������KCl���壬 ƽ�� _____________�ƶ���
ƽ�� _____________�ƶ���
 ��ʱ�ƿ�������ϰϵ�д�
��ʱ�ƿ�������ϰϵ�д� һ��һ��һ��ͨϵ�д�
һ��һ��һ��ͨϵ�д� �㽭֮��ѧҵˮƽ����ϵ�д�
�㽭֮��ѧҵˮƽ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����ѪҺ�������Ҫ�����ƽ�⣺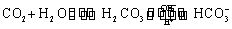 ʹ����ѪҺpH������7.35��7.45������ͻᷢ�����ж�����ж�����pH��
ʹ����ѪҺpH������7.35��7.45������ͻᷢ�����ж�����ж�����pH��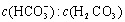 �仯��ϵ���±���
�仯��ϵ���±���
|
| 1.0 | 17.8 | 20.0 | 22.4 |
| pH | 6.10 | 7.35 | 7.4 | 7.45 |
����˵������ȷ���ǣ� ��
A����������ѪҺ�У�HCO3����ˮ��̶ȴ��ڵ���̶�
B������ѪҺ���ж�ʱ����ע��NaHCO3��Һ����
C��pH=7.00��ѪҺ�У�c(H2CO3)��c(HCO3��)��
D��pH=7.40��ѪҺ�У�HCO3����ˮ��̶�һ������H2CO3�ĵ���̶�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���������������ʷֱ���ȫȼ�գ�����CO2���������ǣ� ��
A��C2H6 B��C2H4 C��C2H2 D��C2H6O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ͼΪֱ����Դ���ϡNa2SO4��Һ��װ�á�ͨ��һ��ʱ�����ʯī�缫a��b�����ֱ�μ�һ�η�̪��Һ���������й�˵������ȷ����(����)
A��a�缫����H2
B������������������д̼�����ζ
C��ͨ��һ��ʱ���ϡNa2SO4��Һ������ǿ
D��a�缫��������ɫ��b�缫�����ʺ�ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����������a��b����п��װ���Թ��У��ֱ���������ϡ���ᣬͬʱ��װa���Թ��м�������CuSO4��Һ����ͼ��ʾ�������������V��ʱ��t�Ĺ�ϵ��������ȷ���ǣ� D ��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����������У������ܷų�ij����A���������ò��������ᷴӦ������������A�Ļ�������(����)
A��NH4HCO3 B��K2CO3
C��NaHCO3 D��KClO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���з��ϻ�ѧʵ�顰��ɫ��������(����)
������ȡ��������ʾʵ���У���CCl4��ȡ��ˮ��ΪCCl4��ȡ��ˮ������ͭ��Ũ���ᷴӦ��ʵ���У���ͭƬ��Ϊ�ɵ��ڸ߶ȵ�ͭ˿���۽�ʵ���ҵķ�����ϼ��кͺ����ŷ�
A���٢� B���٢�
C���ڢ� D���٢ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���������Ȼ�ѧ����ʽ�ó��Ľ�����ȷ����
A����֪C(ʯī, s)=C(���ʯ, s) ��H>0������ʯ��ʯī�ȶ�
B����֪C(s)+O2(g)=CO2(g) ��H1 ��C(s)+1/2O2(g)=CO(g) ��H2����H2>��H1
C����֪2H2(g)+O2(g)=2H2O(g) ��H= -483.6 kJ/mol����������ȼ����Ϊ241.8kJ/mol
D����֪NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ��H=-57.3kJ/mol����20gNaOH��ϡ��Һ��ϡ������ȫ�кͣ��к���Ϊ28.65kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ʵ���о����֣����ᷢ��������ԭ��Ӧʱ�������Ũ��Խϡ����Ӧ��ԭ�����е�Ԫ�صĻ��ϼ�Խ�͡�����һ�������ۺ����۵Ļ������һ�����ijŨ�ȵ�ϡ�����ַ�Ӧ����Ӧ������������ų�����֪����Ļ�ԭ������NH4NO3�����ڷ�Ӧ���������Һ�У���μ���5mol·L��1��NaOH��Һ������NaOH��Һ�����(mL)������ij��������ʵ�����ϵ����ͼ��ʾ����
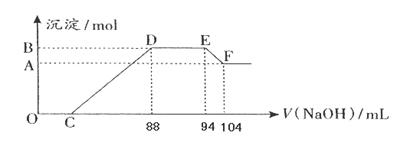
(1)B��A�IJ�ֵΪ�� mol
(2)ԭ������Һ�к���������ʵ���Ϊ�� mol��
(3)���ۺ����۵Ļ���������������۵����ʵ���֮��Ϊ��
(4)д�������Ũ�����ᷴӦ�����ӷ���ʽ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com