
 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案科目:高中化学 来源:2017届河北省高三下学期二调考试理综化学试卷(解析版) 题型:推断题
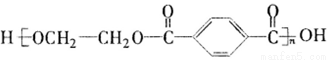
PET是世界上产量最大的合成纤维,其结构简式为:
现以煤的干馏产品A与F为原料制备PET,生产的工艺流程如图所示。
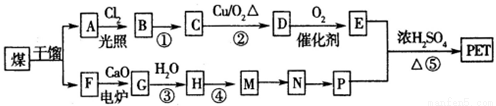
其中A为烃,含碳元素的质最分数为90.6%,其蒸气密度是空气密度的3.66倍,且能使酸性高锰酸钾溶液褪色,但不能使溴水褪色。M分子里所有原子共平面。
请回答下列问题:
(1)A的名称为______。M→N的反应类型为______ ;
(2)反应①的反应条件为:______;
(3)写出有机物A所有一氯代物的结构简式:______。
(4)写出下列反应的化学方程式:
反应②:_________;反应③:_________。D与足量的氢氧化铜悬浊液煮沸:_________;
反应⑤:_________。
(5)P的一种同系物X的分子式为C3H8O2,在核磁共振氢谱图中出现三种信号峰,其峰的强度之比为2:l : l 。则X的结构简式为_________。
查看答案和解析>>
科目:高中化学 来源:广东省2016-2017学年高二上学期期末考试化学(文)试卷 题型:选择题
将40℃的饱和NH4Cl溶液冷却至10℃,有NH4Cl固体析出。该过程中保持不变的是
A. 溶剂的质量 B. 溶质的质量分数
C. NH4Cl的溶解度 D. 溶液中NH4+的数目
查看答案和解析>>
科目:高中化学 来源:广东省2016-2017学年高二上学期期末考试化学(文)试卷 题型:选择题
井水冒泡、有异味和变浑浊是地震的常见征兆,其中可能涉及地下硫铁矿(FeS2)发生的反应:FeS2+H2O===Q+S+H2S↑ (已配平),则物质Q是
A. Fe2O3 B. FeO C. Fe(OH)2 D. Fe(OH)3
查看答案和解析>>
科目:高中化学 来源:广东省2016-2017学年高二上学期期末考试化学(文)试卷 题型:选择题
下列各组物质中,组成元素完全相同的是
A. 石墨与金刚石 B. 水银与银 C. 水晶与石灰石 D. 青铜与铜
查看答案和解析>>
科目:高中化学 来源:2017届浙江省温州市高三第二次选考模拟考试(2月)化学试卷(解析版) 题型:推断题
【加试题】药物K可用于治疗哮喘、系统性红斑狼疮等。其合成路线如下图所示。

已知:
①通常在同一个碳原子上连有两个烃基不稳定,易脱水形成羰基
②醛能发生烃醛缩合反应,再脱水生成不饱和醛:
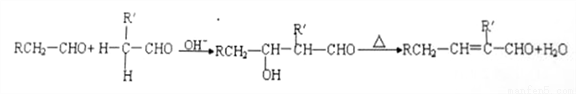
③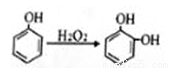
请回答:
(1)下列说法不正确的是_______
A.化合物A能与FeCl3发生显色反应
B.化合物C能够发生银镜反应
C.I转化为J属于加成反应
D.K与足量NaOH溶液反应时,1molK最多可消耗3molNaOH
(2)化合物D的结构简式为_______。
(3)E F的化学方程式为___________。
F的化学方程式为___________。
(4)写成符合下列条件的A的所有同分异构体的结构简式_______。
①能与氯化铁溶液发生显色反应
②1H-NMR谱显示分子中苯环上有两种不同化学环境的氢原子
(5)通常采用有机物H为原料合成有机物I,请设计该合成路线_______(用流程图表示,无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源:2017届浙江省温州市高三第二次选考模拟考试(2月)化学试卷(解析版) 题型:选择题
W、X、Y、Z四种元素在周期表中的位置如图所示,下列说法不正确的是
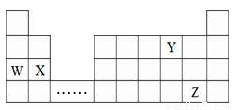
A. W、X、Y三种元素的原子半径依次减少
B. W元素的最高价氧化物的水化物的碱性比X的强
C. 可在省略号对应的族区域寻找各种优良的催化剂
D. Z元素与水反应得到HZO,HZO只有氧化性
查看答案和解析>>
科目:高中化学 来源:2017届陕西省宝鸡市高三教学质量检测(一)理综化学试卷(解析版) 题型:简答题
(1)写出醋酸在水溶液中的电离方程式 。若某温度下,CH3COOH(aq)与NaOH(aq)反应的△H=" -" 46.8kJ·mol-1,HCl(aq)与NaOH(aq)反应的△H=" -" 55.6 kJ·mol-1,则CH3COOH在水溶液中电离的△H= kJ·mol-1。
(2)某温度下,实验测得0.1mol·L-1醋酸电离度约为1.5%,则该温度下0.1mol·L-1CH3COOH的电离平衡常数K=________(列出计算式,已知电离度 )
)
(3)近年来化学家研究开发出用乙烯和乙酸为原料、杂多酸作催化剂合成乙酸乙酯的新工艺,不必生产乙醇或乙醛做中间体,使产品成本降低,具有明显经济优势。其合成的基本反应如下:
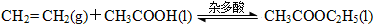
下列描述能说明乙烯与乙酸合成乙酸乙酯的反应已达化学平衡的是 。
A.乙烯、乙酸、乙酸乙酯的浓度相同 |
B.酯化合成反应的速率与酯分解反应的速率相等 |
C.乙烯断开1mol碳碳双键的同时乙酸恰好消耗1mol |
D.体系中乙烯的百分含量一定 |
(4)在n(乙烯)与n(乙酸)物料比为1的条件下,某研究小组在不同压强下进行了在相同时间点乙酸乙酯的产率随温度的变化的测定实验,实验结果如图所示。回答下列问题:
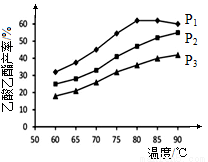
① 温度在60~80℃范围内,乙烯与乙酸酯化合成反应速率由大到小的顺序是 [用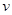 (P1)、
(P1)、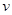 (P2)、
(P2)、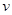 (P3)分别表示不同压强下的反应速率],分析其原因为 。
(P3)分别表示不同压强下的反应速率],分析其原因为 。
②压强为P1MPa、温度60℃时,若乙酸乙酯的产率为30℅,则此时乙烯的转化率为 。
③在压强为P1MPa、温度超过80℃时,乙酸乙酯产率下降的原因可能是_________。
④根据测定实验结果分析,较适宜的生产条件是 (填出合适的压强和温度)。为提高乙酸乙酯的合成速率和产率,可以采取的措施有 (任写出一条)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com