
【题目】下列有关化学用语正确的是( )
A.26Fe的价层电子排布式为3d64s2
B.35Br的电子排布式可简写为[Ar]4s24p5
C.NH4Cl的电子式为 
D.某基态原子核外电子排布图为: ![]()
 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:
【题目】将5mol·L-1的盐酸10mL稀释到200mL,从中取出10mL的溶液的物质的量浓度是
A.0.05 mol·L-1B.0.25 mol·L-1
C.0.10 mol·L-1D.0.50 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在盛有碘水的试管里加入少量四氯化碳,振荡后静置,可观察到
A. 分层,上层呈紫红色,下层颜色变浅
B. 分层,上层颜色变浅,下层呈紫红色
C. 不分层,液体呈紫红色
D. 不分层,液体为无色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
A. 蒸发结晶时,应将溶液蒸干
B. 蒸馏时,应采用逆流原理使冷凝器下口进水上口出水进行冷却
C. 分液操作时,先将分液漏斗中的下层液体放出,然后再将上层液体放出
D. 过滤时,用玻璃棒在漏斗中不停搅动可以缩短过滤所需的时间
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】粗盐提纯的步骤 , , ;粗盐中还含有一些可溶性杂质(CaCl2、MgCl2、SO ![]() ),除去这些杂质依次加过量NaOH(除去Mg2+),过量BaCl2(除去SO
),除去这些杂质依次加过量NaOH(除去Mg2+),过量BaCl2(除去SO ![]() )过量Na2CO3(除去Ca2+、过量Ba2+),过滤操作后,再加入 , 除去(过量的CO
)过量Na2CO3(除去Ca2+、过量Ba2+),过滤操作后,再加入 , 除去(过量的CO ![]() 、OH﹣)有关离子方程式: .
、OH﹣)有关离子方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C1O2是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得C1O2:![]() ,下列说法中正确的是( )
,下列说法中正确的是( )
A. 在反应中H2C2O4既不是氧化剂也不是还原剂
B. 1 mol KClO3参加反应,在标准状况下能得到22.4 L气体
C. 1 mol KClO3参加反应有2 mol电子转移
D. KClO3在反应中是氧化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】净水剂能够改善水质,给人们的生活、健康带来很大的益处。
(1) 明矾[KAl(SO4)2·12H2O]是常见的净水剂。其在水中的电离方程式为_______;明矾可净水是因为在天然水中生成胶状Al(OH)3,Al(OH)3具有____的作用。
(2)碱式氯化铝(简称BAC)是高效净水剂的主要成分。实验室模拟利用铝土矿(主要含Al2O3,还含少量Fe2O3及其他不溶杂质)制取碱式氯化铝[Al2(OH)nCl6-n]的过程如下:
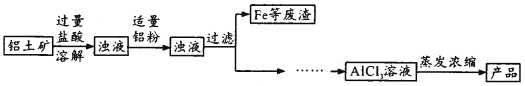
①盐酸溶解铝土矿过程中,发生反应的离子方程式为_____________、_______;溶解过程中需不断搅拌,目的是________________。
②加适量铝粉的主要作用是_______________。
③蒸发浓缩所需玻璃仪器为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色工业废水中可能含有Na+、Mg2+、Al3+、Cl-、SO42-中的几种离子。
a.取少许该废水于试管中,加入足量的Ba(NO3)2溶液和稀硝酸,产生白色沉淀,充分反应后过滤,向滤液中加入AgNO3溶液无沉淀产生。
b.另取10mL该废水于试管中,滴加NaOH溶液先产生白色沉淀,后部分沉淀溶解。生成沉淀的物质的量随加入NaOH的物质的量关系如下图所示。

根据上述实验和图中数据:
(1)该废水中一定不含有的离子有______________________________(填离子符号);
(2)写出A→B过程中发生反应的离子方程式:________________________;
(3)该废水中,c(Al3+)=______________;
(4)①实验室配制100mL2mol/L的NaOH溶液时,用到的玻璃仪器除烧杯、玻璃棒、量筒外,还需要_________(填仪器名称)。
②下列操作使所配溶液浓度偏大的是(填写字母)_________。
A.称量用了生锈的砝码
B.将NaOH放在纸张上称量
C.NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中
D.往容量瓶转移时,有少量液体贱出
E.未洗涤溶解NaOH的烧杯
F.定容时仰视刻度线
G.容量瓶未干燥即用来配制溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱金属元素包括锂、钠、钾、铷、铯、钫等元素,位于元素周期表中第ⅠA族。
(1)画出下列碱金属元素的原子结构示意图:
①锂____________;②钠__________;③钾__________;④铷__________。
(2)比较碱金属元素的原子结构:
①它们在结构上的相同点是___________________________________________________;
②它们在结构上的不同点是___________________________________________________。
(3)碱金属元素原子结构的变化规律是________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com