
分析 (1)表示强酸与强碱反应生成可溶性盐和水的反应;
(2)该反应表示可溶性铜盐与可溶性强碱反应生成氢氧化铜和可溶性盐的反应.
解答 解:(1)OH-+H+═H2O表示强酸与强碱反应生成可溶性盐和水的反应,如:NaOH+HCl=NaCl+H2O,
故答案为:NaOH+HCl=NaCl+H2O;
(2)Cu2++2OH-═Cu(OH)2↓表示可溶性铜盐与可溶性强碱反应生成氢氧化铜沉淀和可溶性盐的一类反应,如:CuSO4+2NaOH═Cu(OH)2↓+Na2SO4,
故答案为:CuSO4+2NaOH═Cu(OH)2↓+Na2SO4.
点评 本题考查离子反应方程式的书写,为高频考点,把握离子反应方程式的意义及离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
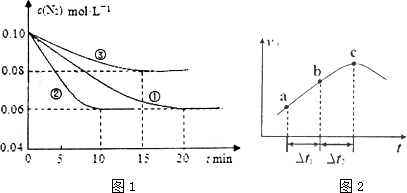
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 以高纯H2为燃料的质子交换膜燃料电池具有能量效率高、无污染等优点,但燃料中若混有CO将显著缩短电池寿命.以甲醇为原料制取高纯H2是重要研究方向.
以高纯H2为燃料的质子交换膜燃料电池具有能量效率高、无污染等优点,但燃料中若混有CO将显著缩短电池寿命.以甲醇为原料制取高纯H2是重要研究方向.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
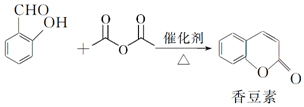
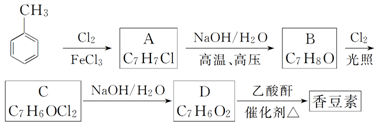
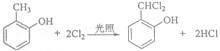 ;
;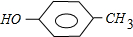 和
和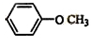 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若忽略水的电离及H2CO3的第二级电离,则H2CO3?HCO3-+H+的平衡常数K1=4.2×10-7 | |
| B. | 少量Cl2通入到过量的Na2CO3溶液的离子方程式为Cl2+2CO32-+H2O═2HCO3-+Cl-+ClO- | |
| C. | Cl2与Na2CO3按物质的量之比1:1恰好反应的离子方程式为Cl2+CO32-+H2O═HCO3-+Cl-+HClO | |
| D. | 少量CO2通入到过量的NaClO溶液的离子方程式为2ClO-+CO2+H2O═CO32-+2HClO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com