
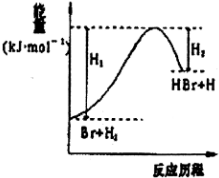
| A. | 该反应为可逆反应 | B. | 加入催化剂,可提高HBr的产率 | ||
| C. | 反应物总能量低于生成物总能量 | D. | 反应物总键能低于生成物总键能 |
分析 A、无法判断是否为可逆反应;
B、催化剂只改变反应速率,不改变平衡移动;
C、根据图象分析反应物的总能量小于生成物的总能量;
D、根据图象分析反应物的总能量小于生成物的总能量,可知为吸热反应判断.
解答 解:A、根据图象分析反应物的总能量小于生成物的总能量,可知为吸热反应,无法判断是否为可逆反应,故A错误;
B、催化剂只改变反应速率,不改变平衡移动,所以加入催化剂,不可提高HBr的产率,故B错误;
C、根据图象可知反应物的总能量小于生成物的总能量,故C正确;
D、根据图象分析反应物的总能量小于生成物的总能量,可知为吸热反应,所以反应物总键能大于生成物总键能,故D错误;
故选C.
点评 本题考查反应热,要掌握反应物的总能量小于生成物的总能量,反应吸热,反应物的总能量大于生成物的总能量,反应放热,题目难度不大.


科目:高中化学 来源: 题型:选择题

| A. | 该烃是苯的同系物 | |
| B. | 该烃分子中至少有9个碳处于同一平面上 | |
| C. | 该烃分子中的所有原子有可能处于同一平面上 | |
| D. | 该烃的一氯代物最多有四种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
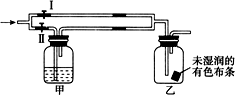 如图所示:若关闭Ⅰ阀,打开Ⅱ阀,让一种含氯气的气体经过甲瓶后,通入乙瓶,布条不褪色,若关闭Ⅱ阀,打开Ⅰ阀,再通入这种气体,布条褪色.甲瓶中所盛的试剂可能是( )
如图所示:若关闭Ⅰ阀,打开Ⅱ阀,让一种含氯气的气体经过甲瓶后,通入乙瓶,布条不褪色,若关闭Ⅱ阀,打开Ⅰ阀,再通入这种气体,布条褪色.甲瓶中所盛的试剂可能是( )| A. | ①②③ | B. | ②③④ | C. | ①②④ | D. | ①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②⑤ | B. | ⑤ | C. | ②③⑤ | D. | ①②③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 二氧化碳与石灰水:CO2+OH-=HCO3- | |
| B. | 氯化铁和硫氢化钠:2Fe3++2HS-=Fe2++2H++FeS↓+S↓ | |
| C. | 硫酸亚铁铵和氢氧化钡:2NH4++2OH-+Ba2++SO42-=2NH3•H2O+BaSO4↓ | |
| D. | 在酸性条件下亚硫酸钠和硫化钠:2SO32-+2S2-+8H+=3S↓+SO2↑+4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,18g14CH4所含中子数目为12NA | |
| B. | 7.8 g Na2S和Na2O2的混合物中含有的阴离子数大于0.1 NA | |
| C. | 常温常压下,1mol NaHCO3与足量稀硫酸反应,生成气体的体积大于22.4L | |
| D. | 1mol NaBH4与足量水反应(NaBH4+H2O→NaBO2+H2↑,未配平)时转移的电子数为8NA |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com