
【题目】我国的矿产资源丰富。利用某冶炼废渣(主要成分为二氧化硅和锡、铜、铅、铁的氧化物)回收锡、铜、铅的工艺流程如下图所示:

回答下列问题:
(1)电炉冶炼时,焦炭的作用是________(填“氧化剂”或“还原剂”),将焦炭粉碎的目的是__________。熔剂的主要成分是氟石(CaF2),高温下能与SiO2反应生成两种钙盐,其中之一为 CaSiF6,该反应的化学方程式为____________________________。![]()
(2)脱铁后的溶液中含有少量的Sn2+,为减少锡的损失,可用锡、铜、铅、铁多元合金回收处理,反应的离子方程式为____________________________。
(3)已知SnO2不溶于稀硫酸。脱铁后氧化焙烧的目的是__________________。
(4)电解CuSO4溶液时,阳极的电极反应式为___________________________。
(5)已知H2CO3的一、二级电离常数分别为K1、K2,PbSO4、PbCO3的溶度积常数分别为Ksp(PbSO4)、Ksp(PbCO3)。锡、铅渣中的铅主要以PbSO4存在,脱硫时发生的反应为:
PbSO4(s)+HCO3ˉ(aq) ![]() PbCO3(s)+H+(aq)+SO42-(aq),该反应的平衡常数K=___________(用上述已知常数表示)。脱硫后需过滤、洗涤再进入下一步工序,检验滤渣是否洗涤干净的方法是_____________________________。
PbCO3(s)+H+(aq)+SO42-(aq),该反应的平衡常数K=___________(用上述已知常数表示)。脱硫后需过滤、洗涤再进入下一步工序,检验滤渣是否洗涤干净的方法是_____________________________。
(6)若该冶炼废渣中锡的质量分数为5%,30t废渣制得精锡lt,则锡的回收率为_____________________。
【答案】 还原剂 加快反应速率使反应更充分 3CaF2+3SiO2 ![]() CaSiF6+2CaSiO3 Sn2++Fe=Sn+Fe2+ 将Sn、Cu分别氧化为SnO2、CuO,利于浸铜时分离 2H2O-4e-=O2↑+4H+
CaSiF6+2CaSiO3 Sn2++Fe=Sn+Fe2+ 将Sn、Cu分别氧化为SnO2、CuO,利于浸铜时分离 2H2O-4e-=O2↑+4H+ ![]() 取少量末次洗涤液于试管中,滴加氯化钡溶液,若不出现浑浊,说明滤渣已洗净(合理答案均可) 66.7%
取少量末次洗涤液于试管中,滴加氯化钡溶液,若不出现浑浊,说明滤渣已洗净(合理答案均可) 66.7%
【解析】(1)电炉冶炼时,焦炭将金属氧化物还原产生合金,焦炭的作用是还原剂,将焦炭粉碎的目的是加快反应速率使反应更充分。熔剂的主要成分是氟石(CaF2),高温下能与SiO2反应生成两种钙盐,其中之一为 CaSiF6,该反应的化学方程式为3CaF2+3SiO2![]() CaSiF6+2CaSiO3;(2)脱铁后的溶液中含有少量的Sn2+,为减少锡的损失,可用锡、铜、铅、铁多元合金回收处理,利用铁金属性强于锡置换出锡,反应的离子方程式为Sn2++Fe=Sn+Fe2+;(3)已知SnO2不溶于稀硫酸。脱铁后氧化焙烧的目的是将Sn、Cu分别氧化为SnO2、CuO,利于浸铜时分离;(4)电解CuSO4溶液时,阳极水电离出的氢氧根离子失电子产生氧气,反应的电极反应式为2H2O-4e-=O2↑+4H+;(5)已知H2CO3的一、二级电离常数分别为K1、K2,PbSO4、PbCO3的溶度积常数分别为Ksp(PbSO4)、Ksp(PbCO3)。锡、铅渣中的铅主要以PbSO4存在,脱硫时发生的反应为PbSO4(s)+HCO3ˉ(aq)
CaSiF6+2CaSiO3;(2)脱铁后的溶液中含有少量的Sn2+,为减少锡的损失,可用锡、铜、铅、铁多元合金回收处理,利用铁金属性强于锡置换出锡,反应的离子方程式为Sn2++Fe=Sn+Fe2+;(3)已知SnO2不溶于稀硫酸。脱铁后氧化焙烧的目的是将Sn、Cu分别氧化为SnO2、CuO,利于浸铜时分离;(4)电解CuSO4溶液时,阳极水电离出的氢氧根离子失电子产生氧气,反应的电极反应式为2H2O-4e-=O2↑+4H+;(5)已知H2CO3的一、二级电离常数分别为K1、K2,PbSO4、PbCO3的溶度积常数分别为Ksp(PbSO4)、Ksp(PbCO3)。锡、铅渣中的铅主要以PbSO4存在,脱硫时发生的反应为PbSO4(s)+HCO3ˉ(aq) ![]() PbCO3(s)+H+(aq)+SO42+(aq),该反应的平衡常数K=
PbCO3(s)+H+(aq)+SO42+(aq),该反应的平衡常数K=![]() ;检验滤渣是否洗涤干净是检验洗涤液中是否含有硫酸根离子,检验的方法是取少量末次洗涤液于试管中,滴加氯化钡溶液,若不出现浑浊,说明滤渣已洗净;(6)若该冶炼废渣中锡的质量分数为5%,30t废渣制得精锡lt,则锡的回收率为
;检验滤渣是否洗涤干净是检验洗涤液中是否含有硫酸根离子,检验的方法是取少量末次洗涤液于试管中,滴加氯化钡溶液,若不出现浑浊,说明滤渣已洗净;(6)若该冶炼废渣中锡的质量分数为5%,30t废渣制得精锡lt,则锡的回收率为![]() 。
。


科目:高中化学 来源: 题型:
【题目】反应A+B―→C分两步进行:①A+B―→X,②X―→C,反应过程中能量变化如图所示,E1表示反应A+B―→X的活化能。下列有关叙述正确的是( )
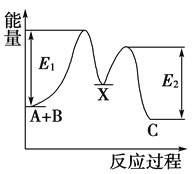
A. E2表示反应X―→C的活化能
B. X是反应A+B―→C的催化剂
C. 反应A+B―→C的ΔH<0
D. 加入催化剂可改变反应A+B―→C的焓变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据问题填空:
(1)氟化氢水溶液中存在的氢键有种;分子(CN)2中键与键之间的夹角为180°,并有对称性,分子中每个原子最外层均满足8电子稳定结构,其结构式为 , 1个分子中含有个π键;
(2)金属镍及其化合物在合金材料以及催化剂等方面应用广泛,NiO的晶体结构类型与氯化钠的相同,NiO晶胞中Ni和O的配位数均为;很多不饱和有机物在Ni催化下可以H2发生加成反应,如①CH2=CH2、②HC≡CH、③ ![]() 、④HCHO等,其中碳原子不是采取sp2杂化的分子有(填物质编号),HCHO分子的立体构型为 .
、④HCHO等,其中碳原子不是采取sp2杂化的分子有(填物质编号),HCHO分子的立体构型为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A(g)+B(g)C(g)+D(g)反应的平衡常数和温度的关系如下:
温度/℃ | 700 | 900 | 830 | 1000 | 1200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应的平衡常数表达式K= , △H0(填“<”“>”“=”);
(2)830℃时,向一个5L的密闭容器中充入0.20mol的A和0.80mol的B,如反应初始6s内A的平均反应速率v(A)=0.003molL﹣1s﹣1 . ,则6s时c(A)= molL﹣1 , C的物质的量为mol;若反应经一段时间后,达到平衡时A的转化率为 , 如果这时向该密闭容器中再充入1mol氩气,平衡时A的转化率为;
(3)判断该反应是否达到平衡的依据为(填正确选项前的字母): a.压强不随时间改变 b.气体的密度不随时间改变
c.c(A)不随时问改变 d.单位时间里生成c和D的物质的量相等
(4)1200℃时反应C(g)+D(g)A(g)+B(g)的平衡常数的值为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】只用下列试剂中的一种就能鉴别Ba(NO3)2、Na2CO3、K2SO4三种溶液,则该试剂是
A.KNO3溶液B.稀H2SO4C.NaOH溶液D.Na2SO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用溴和苯反应制取溴苯,得到粗溴苯后,要用如下操作精制:
①蒸馏;②水洗;③用干燥剂干燥;④10%NaOH溶液洗;⑤水洗。
正确的操作顺序是
A. ①②③④⑤ B. ④②③①⑤ C. ②④①⑤③ D. ②④⑤③①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有通电条件下,用如图所示装置由乙二醛(OHC-CHO)制备乙二酸(HOOC-COOH),其反应为:OHC-CHO+2Cl2+2H2O![]() HOOC-COOH+4HCl。下列说法正确的是
HOOC-COOH+4HCl。下列说法正确的是
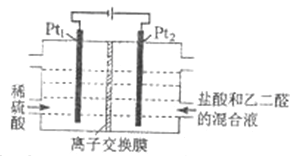
A. Pt1的电极反应为:2H2O+ 2e-=2OH-+H2↑
B. 盐酸起提供Cl- 和增强导电性的作用
C. 每消耗0.1mol乙二醛,在Pt1极放出2.24 L 气体(标准状况)
D. 每得到1mol乙二酸将有2 mol H+从右室迁移到左室
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com