
| A. | AgCl不溶于水,不能转化为AgI | |
| B. | 在含有浓度均为0.001 mol•L-1的Cl-、I-的溶液中缓慢加入AgNO3稀溶液,首先析出AgI沉淀 | |
| C. | AgI比AgCl更难溶于水,所以,AgCl可以转化为AgI | |
| D. | 常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于$\frac{1}{\sqrt{1.8}}$×10-11mol•L-1 |
分析 A.如满足Qc>Ksp,则AgCl能转化为AgI;
B.根据溶解度小的物质先生成沉淀;
C.根据沉淀转化原理分析;
D.根据Ksp(AgCl)求出c(Ag+),再利用Ksp(AgI)求出碘离子的浓度.
解答 解:A.AgCl难溶,但是AgI溶解度更小,所以AgCl能转化为AgI,故A错误;
B.在含浓度均为0.001mol•L-1的Cl-、I-的溶液中缓慢滴AgNO3稀溶液,由于AgI的溶度积小,即溶解度小,所以AgI先形成沉淀析出,故B正确;
C.根据沉淀转化原理:溶解度小的能转化为溶解度更小的,所以AgCl可以转化为AgI,故C正确;
D.已知Ksp(AgCl)=1.8×10-10,则c(Ag+)=$\sqrt{Ksp(AgCl)}$=$\sqrt{1.8×1{0}^{-10}}$,c(I-)=$\frac{Ksp(AgI)}{c(A{g}^{+})}$=$\frac{1.0×1{0}^{-16}}{\sqrt{1.8×1{0}^{-10}}}$=$\frac{1}{\sqrt{1.8}}$×10-11mol,故D正确;
故选:A
点评 本题考查难溶电解质的溶解平衡及沉淀转化的本质,为高频考点,侧重于学生的分析能力和实验能力的考查,注意沉淀转化为溶解度更小的物质容易发生,题目难度不大.


科目:高中化学 来源: 题型:推断题

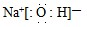 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④ | B. | ①③ | C. | ⑤⑥ | D. | ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


| 物质 | Na | S | Al2O3 |
| 熔点/℃ | 97.8 | 115 | 2050、 |
| 沸点/℃ | 892 | 444.6 | 2980 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 乙二酸俗名草酸,下面是化学学习小组的同学对草酸晶体(H2C2O4•xH2O)进行的探究性学习的过程,请你参与并协助他们完成相关学习任务.该组同学的研究课题是:探究测定草酸晶体(H2C2O4•xH2O)中的x值.通过查阅资料和网络查寻得,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O学习小组的同学设计了滴定的方法测定x值.
乙二酸俗名草酸,下面是化学学习小组的同学对草酸晶体(H2C2O4•xH2O)进行的探究性学习的过程,请你参与并协助他们完成相关学习任务.该组同学的研究课题是:探究测定草酸晶体(H2C2O4•xH2O)中的x值.通过查阅资料和网络查寻得,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O学习小组的同学设计了滴定的方法测定x值.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 滴定次数 | 待测液体积/ml | 标准盐酸体积/ml | |
| 滴定前读数/ml | 滴定后读数/ml | ||
| 第一次 | 10.00 | 0.20 | 22.90 |
| 第二次 | 10.00 | 0.50 | 20.40 |
| 第三次 | 10.00 | 4.00 | 24.10 |
| 第四次 | 10.00 | 0.00 | 20.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 4.2 | 5.4 |
| 沉淀完全的pH | 3.3 | 9.7 | 6.7 | 8.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 做焰色反应实验用的铂丝要用受热容易挥发的稀盐酸洗涤 | |
| B. | 观察K2SO4的焰色应透过蓝色的钴玻璃 | |
| C. | 可以用焰色反应来区别NaCl溶液和KCl溶液 | |
| D. | 焰色反应一定是化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在反应中不一定所有元素的化合价都发生变化 | |
| B. | 肯定有一种元素被氧化,另一种元素被还原 | |
| C. | 非金属单质在反应中只做氧化剂 | |
| D. | 某元素从化合物变为单质时,该元素一定被还原 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com