
| a | 原子核外电子分别占3个不同能级,且每个能级上排布的电子数相同 |
| b | 基态原子的p轨道电子数比s轨道电子数少1 |
| c | 在周期表所列元素中电负性最大 |
| d | 基态原子M层全充满,N层只有一个电子 |
 .
.分析 a、b、c、d、e均为周期表前四周期元素,原子序数依次增大,a原子核外电子分占3个不同能级,且每个能级上排布的电子数相同,核外电子排布为1s22s22p2,故a为C元素;b元素基态原子的p轨道电子数比s轨道电子数少1,核外电子排布为1s22s22p3,故b为N元素;c在周期表所列元素中电负性最大,则c为F元素;d位于周期表中第4纵行,且处于第四周期,故d为Ti;e的基态原子M层全充满,N层只有一个电子,则核外电子数为2+8+18+1=29,故e为Cu,据此解答.
解答 解:a、b、c、d、e均为周期表前四周期元素,原子序数依次增大,a原子核外电子分占3个不同能级,且每个能级上排布的电子数相同,核外电子排布为1s22s22p2,故a为C元素;b元素基态原子的p轨道电子数比s轨道电子数少1,核外电子排布为1s22s22p3,故b为N元素;c在周期表所列元素中电负性最大,则c为F元素;d位于周期表中第4纵行,且处于第四周期,故d为Ti;e的基态原子M层全充满,N层只有一个电子,则核外电子数为2+8+18+1=29,故e为Cu.
(l)c为F元素,原子核外电子排布为1s22s22p5,核外存在4对自旋相反的电子,其基态原子的价电子排布图为 ,
,
故答案为:4; ;
;
(2)与b同周期相邻元素分别为C、O,同周期随原子序数增大,第一电离能呈增大趋势,但N元素原子2p能级容纳3个电子,为半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能由大到小的顺序为:N>O>C,
故答案为:N>O>C;
(3)a元素最高价氧化物水化物的酸根离子为CO32-,离子中C原子价层电子对数=3+$\frac{4+2-2×3}{2}$=3,没有孤电子对,故碳酸根离子为平面三角形结构,中心C原子的轨道杂化类型为 sp3杂化,
故答案为:平面三角形;sp3杂化;
(4)c的氢化物为NH3,极易溶于水,除因为与水分子之间易形成氢键处,还因为:氨气与水分子都是极性分子,相似相溶,
故答案为:氨气与水分子都是极性分子,相似相溶;
(5)Cu可形成面心立方最密堆积的晶体,晶胞中Cu原子数目为6×$\frac{1}{2}$+8×$\frac{1}{8}$=4,晶胞质量为4×$\frac{M}{{N}_{A}}$g,晶体密度为ag/cm3,则晶胞的体积为4×$\frac{M}{{N}_{A}}$g÷ag/cm3=$\frac{4M}{{aN}_{A}}$cm3,
故答案为:$\frac{4M}{{aN}_{A}}$cm3.
点评 本题是对物质结构的考查,涉及核外电子排布、电离能、分子结构与性质、晶胞计算等,明确元素种类是解题关键,注意同周期元素第一电离能异常情况,注意利用均摊法进行晶胞的有关计算,难度中等.


 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案 小学学习好帮手系列答案
小学学习好帮手系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
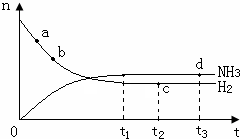 氨气是一种重要的化工原料,大量用于制造尿素、纯碱、铵态氮肥以及硝酸,在有机合成工业中制合成纤维、塑料、染料等.请回答下列问题:
氨气是一种重要的化工原料,大量用于制造尿素、纯碱、铵态氮肥以及硝酸,在有机合成工业中制合成纤维、塑料、染料等.请回答下列问题:| 容器编号 | 起始时各物质物质的量/mol | 平衡时反应 | ||
| N2 | H2 | NH3 | ||
| a | 1 | 3 | 0 | 23.1 |
| b | 2 | 6 | 0 | 未知(用E表示) |
| 容器 | c(CO2) /mol•L-1 | c(H2) /mol•L-1 | c(CH3OCH3) /mol•L-1 | c(H2O) /mol•L-1 | v (正)和v (逆)比较 |
| 容器I | 1.0×10-2 | 1.0×10-2 | 1.0×10-4 | 1.0×10-4 | v (正)=v (逆) |
| 容器II | 2.0×10-2 | 1.0×10-2 | 1.0×10-4 | 2.0×10-4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知2H2(g)+O2(g)═2H2O(g),△H=-483.6kJ,则氢气的燃烧热为241.8kJ•mol-1 | |
| B. | 已知OH-(aq)+H+(aq)═H2O(l)△H=-57.3kJ•mol-1,则含40.0gNaOH的稀溶液与稀醋酸完全中和,放出57.3kJ的热量 | |
| C. | 已知2C(s)+2O2(g)═2CO2(g)△H=a;2C(s)+O2(g)═2CO(g),△H=b,则a>b | |
| D. | 已知C(石墨,s)═C(金刚石,s)△H>0,则石墨比金刚石稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
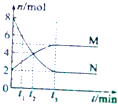 研究化学反应的快慢和限度具有十分重要的意义,请回答下列问题:
研究化学反应的快慢和限度具有十分重要的意义,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
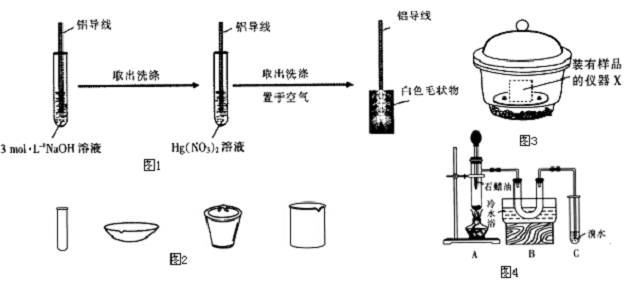
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不锈钢是一种纯净物,它比纯铁的硬度大 | |
| B. | 铝合金是用量最大、用途最广的合金 | |
| C. | 青铜、硬铝和生铁都属于合金 | |
| D. | Na-K合金的熔点介于Na和K单质熔点之间 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 陶瓷的主要成分是碳酸钙 | |
| B. | 用铁容器存放浓盐酸 | |
| C. | 硅是制造半导体的常用材料 | |
| D. | 工业上利用氨气制硝酸属于人工固氮 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com