
| A. | 消除硫酸厂尾气中的SO2:SO2+2NH3+H2O═(NH4)2SO3 | |
| B. | 消除制硝酸工业尾气中的氢氧化物:NO2+NO+2NaOH═2NaNO2+H2O | |
| C. | 制CuSO4:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O | |
| D. | 制CuSO4:2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO,CuO+H2SO4(稀)═CuSO4+H2O |
分析 绿色化学定义是:原料中的所有原子均转化为所要制取的物质,据此定义判断即可.
解答 解:A、SO2+2NH3+H2O═(NH4)2SO3,反应物全部变成亚硫酸铵,符合绿色化学思想,故A不选;
B、NO2+NO+2NaOH═2NaNO2+H2O,一氧化氮与二氧化氮均转变成亚硝酸钠,另外一种产物是水,无污染,符合绿色化学思想,故B不选;
C、Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,有二氧化硫气体生成,会对大气造成污染,不符合绿色化学思想,故C选;
D、2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO,CuO+H2SO4(稀)═CuSO4+H2O,符合绿色化学思想,故D不选,
故选C.
点评 本题主要考查的是绿色化学的定义,绿色化学要求原料全部转化,不浪费、无污染,从源头上做起,难度不大.


 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:选择题
 如图所示的原电池装置,X、Y为两电极,电解质溶液为稀硫酸,外电路中的电子流向如图所示,对此装置的下列说法正确的是( )
如图所示的原电池装置,X、Y为两电极,电解质溶液为稀硫酸,外电路中的电子流向如图所示,对此装置的下列说法正确的是( )| A. | 外电路的电流方向为:X→外电路→Y | |
| B. | 若两电极分别为Zn和石墨棒,则X为石墨棒,Y为Zn | |
| C. | 若两电极都是金属,则它们的活动性为X>Y | |
| D. | X极上发生的是还原反应,Y极上发生的氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸溶液中离子浓度的关系满足:c(H+)═c(OH-)+c(CH3COO-) | |
| B. | 用0.100 0 mol•L-1NaOH滴定未知浓度的CH3COOH溶液,恰好反应时:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| C. | pH=2的HA溶液与pH=12的MOH溶液以任意比混合:c(H+)+c(M+)═c(OH-)+c(A-) | |
| D. | 物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)+c(CH3COOH)═c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑤ | B. | ①③⑥ | C. | ①③④ | D. | ②⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
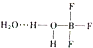 硼元素在化学中很重要的地位,硼及其化合物广泛应用于水磁材料、超导材料、富燃料材料、复合材料等高新材料领域应用.
硼元素在化学中很重要的地位,硼及其化合物广泛应用于水磁材料、超导材料、富燃料材料、复合材料等高新材料领域应用.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ag+、Na+、NO3-、Cl- | B. | H+、Mg2+、SO42-、ClO- | ||
| C. | Cu2+、Mg2+、SO42-、NO3- | D. | NH4+、Ba2+、NO3-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向溴乙烷中滴入AgNO3溶液检验其中的溴元素:Br-+Ag+═AgBr↓ | |
| B. | 一定条件下,将0.5mol N2(g)和1.5molH2(g)置于密闭的容器中,充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-38.6kJ•mol-1 | |
| C. | 0.01mol•L-1NH4Al(SO4)2溶液与0.02mol•L-1Ba(OH)2溶液等体积混合:NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3•H2O | |
| D. | CO(g)的燃烧热是283.0 kJ•mol-1,则CO2分解的热化学方程式为:2CO2(g)=2CO(g)+O2(g)△H=+283.0 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图1现象说明该反应为放热反应 | |
| B. | 图2中b点的操作是压缩注射器 | |
| C. | c点:v(正)>v(逆) | |
| D. | 若不忽略体系温度变化,且没有能量损失,则T(d)<T(c) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 和
和 .化合物 I的名称是间硝基苯甲醛.
.化合物 I的名称是间硝基苯甲醛. .(不要求写出反应条件)
.(不要求写出反应条件) 代替化合物 I发生反应②、反应③可以得到化合物Ⅵ(生产有机玻璃的中间体),化合物Ⅵ的结构简式为
代替化合物 I发生反应②、反应③可以得到化合物Ⅵ(生产有机玻璃的中间体),化合物Ⅵ的结构简式为 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com