
 室温下,用0.100mol/L NaOH 溶液分别滴定20.00mL 0.100mol/L的盐酸和醋酸,滴定曲线如图所示.下列说法正确的是( )
室温下,用0.100mol/L NaOH 溶液分别滴定20.00mL 0.100mol/L的盐酸和醋酸,滴定曲线如图所示.下列说法正确的是( )| A. | V(NaOH)=10.00 mL 时,$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$>1 | |
| B. | Ⅰ、Ⅱ分别表示盐酸和醋酸的滴定曲线 | |
| C. | pH=7时,两种酸所用NaOH溶液的体积相等 | |
| D. | V(NaOH)=20.00 mL 时,c(Cl-)<c(CH3COO-) |
分析 A.醋酸电离大于醋酸根的水解程度,加入10ml氢氧化钠时,溶液中恰好为同浓度的醋酸和醋酸钠;
B.根据盐酸和醋酸在滴定开始时的pH来判断,滴定开始时0.1000mol/L盐酸pH=1,0.1000mol/L醋酸pH>1;
C.醋酸钠水解呈碱性;
D.V(NaOH)=20.00 mL 时,二者反应生成氯化钠和醋酸钠.
解答 解:A.加入10ml氢氧化钠时,溶液中恰好为同浓度的醋酸和醋酸钠,醋酸电离大于醋酸根的水解程度,故$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$>1,故A正确;
B.滴定开始时0.1000mol/L盐酸pH=1,0.1000mol/L醋酸pH>1,所以滴定盐酸的曲线是图Ⅱ,滴定醋酸的曲线是图Ⅰ,故B错误;
C.醋酸钠水解呈碱性,氯化钠不水解,pH=7时,醋酸所用NaOH溶液的体积小,故C错误;
D.V(NaOH)=20.00 mL 时,二者反应生成氯化钠和醋酸钠,醋酸根发生水解,浓度小于氯离子,故D错误.
故选A.
点评 本题考查NaOH与CH3COOH、盐酸的反应,涉及盐类的水解和溶液离子浓度的大小比较知识,注意利用醋酸电离大于醋酸根的水解程度做题.


 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.023mol/L | B. | 0.045mol/L | C. | 0.45mol/L | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
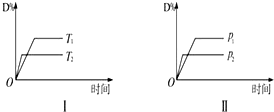 对于可逆反应mA(g)+nB(s)?pC(g)+qD(g)反应过程中,其他条件不变时,D的百分含量与温度(T)或压强(P)关系如图所示,反应达平衡后,下列叙述正确的是( )
对于可逆反应mA(g)+nB(s)?pC(g)+qD(g)反应过程中,其他条件不变时,D的百分含量与温度(T)或压强(P)关系如图所示,反应达平衡后,下列叙述正确的是( )| A. | 升高温度,平衡正移 | |
| B. | 使用催化剂,D的百分含量增加 | |
| C. | m<p+q | |
| D. | B的颗粒越小,反应速率越快,有利于平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 可逆反应:mA(s)+nB(g)qC(g),在一定温度的密闭容器中进行,B的体积分数(V(B)%)与压强的关系如图所示.下列叙述中正确的是( )
可逆反应:mA(s)+nB(g)qC(g),在一定温度的密闭容器中进行,B的体积分数(V(B)%)与压强的关系如图所示.下列叙述中正确的是( )| A. | m+n<q | B. | m+n>q | C. | n>q | D. | x点时,v(正)>v(逆) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H1>△H2>△H3 | B. | △H1>△H3>△H2 | C. | △H3>△H2>△H1 | D. | △H2>△H1>△H3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下22.4L Cl2与足量NaOH溶液反应生成NaCl和NaClO,转移电子数为Na | |
| B. | 16g甲烷中含有的非极性共价键键数为4Na | |
| C. | 一定两点额SO2溶于水后形成pH为2的水溶液,其中H+的数目为0.01Na | |
| D. | 1.8gD2O中含有的质子数为2Na |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com