
【题目】某研究性学习小组同学查阅资料得知,漂白粉与硫酸溶液反应可制取氯气,化学方程式为Ca(ClO)2+CaCl2+2H2SO4 ![]() 2CaSO4+2Cl2↑+2H2O,他们设计了如图1所示的制取氯气并验证其性质的实验装置:
2CaSO4+2Cl2↑+2H2O,他们设计了如图1所示的制取氯气并验证其性质的实验装置: 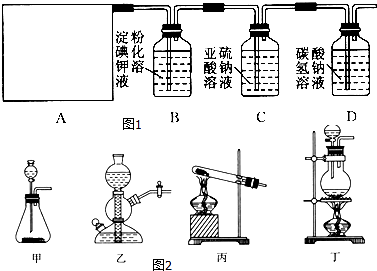
请回答下列问题:
(1)该实验中A部分的装置是图2中的 .
(2)A中发生反应一段时间后,B中的现象是 . B中发生反应的化学方程式为 .
整套实验装置存在的明显缺陷是 .
(3)写出D装置中发生反应的离子方程式 .
(4)请你帮该小组同学设计一个实验,证明洗气瓶C中的Na2SO3已被氧化为Na2SO4(简述实验步骤): .
【答案】
(1)丁
(2)溶液变蓝;2KI+Cl2=2KCl+I2;无尾气吸收装置
(3)Cl2+H2O═H++Cl﹣+HClO,H++HCO3﹣═H2O+CO2↑
(4)取少量溶液置于洁净的试管中,向其中加入稀HCl至不再产生气体,再向其中滴入氯化钡溶液,若产生白色沉淀,则证明亚硫酸钠被氧化
【解析】解:(1)从方程式可知反应物是固体和液体,反应条件是加热,所以应选固液混合加热型装置,故答案为:丁;(2)氯气具有强的氧化性,碘化钾反应2KI+Cl2═2KCl+I2 , 生成的I2遇到淀粉变蓝色;氯气是有毒的气体,不能直接排放到空气中,要用尾气处理装置处理;
故答案为:溶液变成蓝色;2KI+Cl2═2KCl+I2;无尾气吸收;(3)D装置中发生两个反应:氯气和水反应、盐酸和碳酸氢钠,反应的离子方程式分别为:Cl2+H2O═H++Cl﹣+HClO,H++HCO3﹣═H2O+CO2↑,
故答案为:Cl2+H2O═H++Cl﹣+HClO,H++HCO3﹣═H2O+CO2↑.(4)亚硫酸钠被氧化生成硫酸钠,只有验证硫酸根离子的存在就可证明亚硫酸钠已经被氧化,检验硫酸根离子的存在选用试剂稀盐酸和氯化钡溶液,实验设计如下:取少量溶液置于洁净试管中,向其中加入稀盐酸至不再产生气体,再向其中滴入氯化钡溶液,若产生白色沉淀证明Na2SO3已被氧化;
故答案为:取少量溶液置于洁净试管中,向其中加入稀盐酸至不再产生气体,再向其中滴入氯化钡溶液,若产生白色沉淀证明Na2SO3已被氧化;
依据实验目的:制取氯气并验证其性质,依据化学方程式为Ca(ClO)2+CaCl2+2H2SO4 ![]() 2CaSO4+2Cl2↑+2H2O中反应物状态和反应条件选择发生装置,然后依次通入盛有淀粉碘化钾溶液的B、亚硫酸钠溶液的C、碳酸氢钠溶液的D验证氯水的性质,注意氯气有毒,需要进行尾气处理,据此解答;(1)根据反应物的状态及反应条件选择气体的发生装置;(2)氯气具有强的氧化性,与碘化钾反应生成单质碘和氯化钾,单质碘遇淀粉变蓝;氯气是有毒的气体,不能直接排放到空气中,要用尾气处理装置处理;(3)氯气溶于水和水反应生成盐酸和次氯酸,盐酸和碳酸氢钠反应生成水和二氧化碳;(4)亚硫酸钠被氧化生成硫酸钠,只有验证硫酸根离子的存在就可证明亚硫酸钠已经被氧化;
2CaSO4+2Cl2↑+2H2O中反应物状态和反应条件选择发生装置,然后依次通入盛有淀粉碘化钾溶液的B、亚硫酸钠溶液的C、碳酸氢钠溶液的D验证氯水的性质,注意氯气有毒,需要进行尾气处理,据此解答;(1)根据反应物的状态及反应条件选择气体的发生装置;(2)氯气具有强的氧化性,与碘化钾反应生成单质碘和氯化钾,单质碘遇淀粉变蓝;氯气是有毒的气体,不能直接排放到空气中,要用尾气处理装置处理;(3)氯气溶于水和水反应生成盐酸和次氯酸,盐酸和碳酸氢钠反应生成水和二氧化碳;(4)亚硫酸钠被氧化生成硫酸钠,只有验证硫酸根离子的存在就可证明亚硫酸钠已经被氧化;


科目:高中化学 来源: 题型:
【题目】已知:H2(g)+I2(g)2HI(g)△H=﹣14.9kJ/mol.某温度下在甲、乙两个恒容密闭容器中充入反应物,其起始浓度如下表所示.甲中反应达到平衡时,测得c(H2)=0.008mol/L. 下列判断正确的( )
起始浓度 | c(H2)/mol/L | c(I2)/mol/L | c(HI)/mol/L |
甲 | 0.01 | 0.01 | 0 |
乙 | 0.02 | 0.02 | 0 |
A.平衡时,乙中H2的转化率是甲中的2倍
B.平衡时,甲中混合物的颜色比乙中深
C.平衡时,甲、乙中热量的变化值相等
D.该温度下,反应的平衡常数K=0.25
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关系的表述中,正确的是( )
A.0.1mol?L﹣1NaHSO4溶液中:c(Na+)+c(H+)=c(SO ![]() )+c(OH﹣)
)+c(OH﹣)
B.中和pH和体积都相同的盐酸和醋酸,消耗NaOH的物质的量之比为1:1
C.pH=3的盐酸和pH=3的FeCl3溶液中,水电离的c(H+)不相等
D.0.1mol?L﹣1NaHCO3溶液中:c(Na+)>c(HCO ![]() )>c(CO
)>c(CO ![]() )>c(H2CO3)
)>c(H2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO很容易与许多分子迅速发生反应,科学家发现在生物体中不断地产生NO,用于细胞间传递信息;NO还参与心血管系统、免疫系统以及中枢和外围神经系统的调控.
(1)NO是有毒气体,某学生为防止污染,用分液漏斗和烧杯装配了一套简易的、能随开随用、随关随停的NO气体发生装置,如图甲所示.①实验室若没有铜丝,而只有小铜粒,在使用上述装置进行实验时,可用丝状材料包裹铜粒以代替铜丝进行实验,这种丝状材料的成分可以是(填字母).
A.铁B.铝C.铂D.玻璃
②打开分液漏斗的活塞使反应进行,在分液漏斗中实际看到的气体是红棕色的,原因是(填化学方程式).
(2)为证明铜丝与稀硝酸反应生成的确实是NO,某学生另设计了一套如图乙所示的装置制取NO.反应开始后,可以在U形管右端观察到无色的NO气体.①长玻璃管的作用是 .
②让反应停止的操作方法及原因是 .
(3)以下收集NO气体的装置(图丙),合理的是(填选项代号).
(4)假设实验中12.8 g Cu全部溶解,需要通入标况下O2才能使NO全部溶于水.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化工生产中常利用硫酸厂煅烧黄铁矿石的烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)来制备聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO4·7H2O),流程如下:
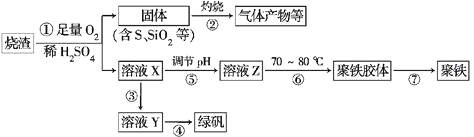
(1)将过程②中产生的气体通入下列溶液中,溶液会褪色的是________(填选项序号)。
a.品红溶液 b.紫色石蕊溶液 c.酸性KMnO4溶液 d.溴水
(2)过程①中,FeS和O2、H2SO4反应的离子方程式为______________________
(3)过程③中,需加入的物质是____________;反应的化学方程式为_____________________
如何检验溶液Y中存在Fe2+?__________________________________________
(4)在实验室里,完成过程④的操作是____________(填操作名称),需要使用酒精灯、三脚架、坩埚钳等,还需要的陶瓷仪器有___________________________。
(5)实验室为测量所得到的聚铁样品中铁元素的质量分数,进行下列实验:①用分析天平称取2.700 g样品;②将样品溶于足量的盐酸后,加入过量的氯化钡溶液;③过滤、洗涤、干燥、称量,得固体质量为3.495 g。若该聚铁的主要成分为[Fe(OH)SO4]n,则聚铁样品中铁元素的质量分数为________。(假设杂质中不含铁元素和硫元素)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上设计将VOSO4中的K2SO4、SiO2杂质除去并回收得到V2O5的流程如下: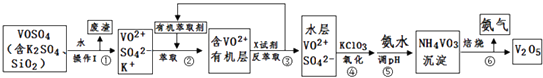
请回答下列问题:
(1)步骤①所得废渣的成分是(写化学式),操作I的名称 .
(2)步骤②、③的变化过程可简化为(下式R表示VO2+ , HA表示有机萃取剂):R2(SO4)n (水层)+2nHA(有机层)2RAn(有机层)+nH2SO4 (水层)
②中萃取时必须加入适量碱,其原因是 .
③中X试剂为 .
(3)⑤的离子方程式为 .
(4)25℃时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如下表:
pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
钒沉淀率% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
结合上表,在实际生产中,⑤中加入氨水,调节溶液的最佳pH为;若钒沉淀率为93.1%时不产生Fe(OH)3沉淀,则溶液中c(Fe3+)< .
(5)该工艺流程中,可以循环利用的物质有和 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com