
| A. | 吸热44kJ | B. | 吸热2.44KJ | C. | 放热44kJ | D. | 放热2.44KJ |
分析 根据盖斯定律,由H2O(g)=H2(g)+$\frac{1}{2}$O2(g);△H=+241.8kJ/mol①
H2(g)+$\frac{1}{2}$O2(g)=H2O(l);△H=-285.8kJ/mol②
将方程式①+②确定液态水变成水蒸气的热化学反应方程式,再根据热化学反应方程式进行计算.
解答 解:H2O(g)=H2(g)+$\frac{1}{2}$O2(g);△H=+241.8kJ/mol①
H2(g)+$\frac{1}{2}$O2(g)=H2O(l);△H=-285.8kJ/mol②
将方程式①+②得H2O(g)=H2O(l);△H=+241.8kJ/mol-285.8kJ/mol=-44kJ/mol,
所以H2O(l)=H2O(g);△H=+44kJ/mol,
1g水的物质的量=$\frac{1g}{18g/mol}$=$\frac{1}{18}$,当1g液态水变为水蒸气时,吸收热量=$\frac{1}{18}$×44kJ/mol=2.44kJ,
故选B.
点评 本题考查了反应热的计算,注意该题中水已知条件是水的质量而不是物质的量,为易错点.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:解答题
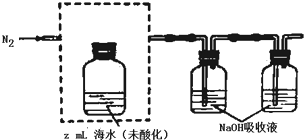
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
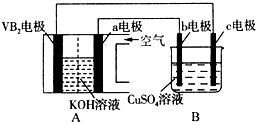 碱性硼化钒(VB2)-空气电池工作时反应为:4VB2+11O2═4B2O3+2V2O5.用该电池为电源,选用惰性电极电解硫酸铜溶液,实验装置如图所示.当外电路中通过0.04mol电子时,B装置内共收集到0.448L气体(标准状况),则下列说法正确的是( )
碱性硼化钒(VB2)-空气电池工作时反应为:4VB2+11O2═4B2O3+2V2O5.用该电池为电源,选用惰性电极电解硫酸铜溶液,实验装置如图所示.当外电路中通过0.04mol电子时,B装置内共收集到0.448L气体(标准状况),则下列说法正确的是( )| A. | 电解过程中,c电极表面先有红色物质析出,然后有气泡产生 | |
| B. | VB2电极发生的电极反应为:2VB2+11H2O-22e-═V2O5+2B2O3+22H+ | |
| C. | 外电路中电子由c电极流向VB2电极 | |
| D. | 若B装置内的液体体积为200 mL,则CuSO4溶液的物质的量浓度为0.1 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
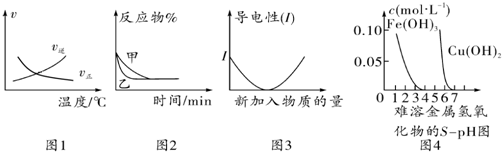
| A. | 根据图1可判断可逆反应“A2(g)+3B2(g)?2AB3(g)”的△H<0 | |
| B. | 图2可能表示压强对可逆反应 A(g)+2B(g)?3C(g)+D(s)的影响,乙的压强大 | |
| C. | 图3可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化 | |
| D. | 根据图4,若除去CuSO4溶液中的Fe3+可采用向溶液中加入适量Cu至pH在4左右 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuFeS2既是氧化剂又是还原剂,硫元素既被氧化又被还原 | |
| B. | 每生成1molSO2转移6mol电子 | |
| C. | SO2既是氧化产物又是还原产物,FeS只是还原产物 | |
| D. | 每转移1.2 mol电子,有0.3 mol氧气被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用容量瓶、量筒、滴定管等仪器时,先用水洗后还需待装液润洗 | |
| B. | 洗涤沉淀的操作是将沉淀置于滤纸上(已放置在漏斗中),边用玻璃棒搅拌边加蒸馏水冲洗 | |
| C. | 为提升燃料电池的效率,通常可以用KNO3代替蒸馏水,同时作电极的碳棒先灼烧,然后投入到冷水中,反复3-5次 | |
| D. | 在制取乙酸乙酯的实验中,收集乙酸乙酯的试管中加的是饱和Na2CO3溶液,而且导管直接插入到饱和Na2CO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com