
| A、Na2CO3、NaHCO3两种盐的溶液中,离子种类相同 | ||
| B、在CH3COONa溶液中c (CH3COO-)>c(Na+)>c(OH-)>c(H+) | ||
C、在0.1mol?L-1的醋酸溶液中加入适量的蒸馏水,溶液的
| ||
| D、常温下,某溶液中由水电离出的c(H+)为10-5 mol/L,则此溶液可能是盐酸 |
| c(H+) |
| c(CH3COOH) |


 步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源: 题型:
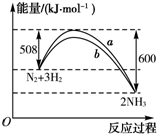
| A、该反应的热化学方程式为N2+3H2?2NH3△H=-92 kJ?mol-1 |
| B、a曲线是加入催化剂时的能量变化曲线 |
| C、加入催化剂,该化学反应的反应热改变 |
| D、升高温度,反应速率加快 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2H2(g)+O2(g)═2H2O(l)△H═-572kJ?mol-1 |
| B、KOH(aq)+CH3COOH (aq)=CH3COOK (aq)+H2O(l);△H=-57.3 kJ?mol-1 |
| C、C8H18(l)+12.5O2 (g)=8CO2(g)+9H2O(l);△H=-5518 kJ?mol-1 |
| D、CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H═-533kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 高锰酸钾是一种重要的化学试剂,其溶液不很稳定,在酸性条件下会分解生成二氧化锰和氧气,在中性或弱碱性溶液中分解速度很慢,见光分解速度加快.
高锰酸钾是一种重要的化学试剂,其溶液不很稳定,在酸性条件下会分解生成二氧化锰和氧气,在中性或弱碱性溶液中分解速度很慢,见光分解速度加快.滴入高锰酸钾溶液的次序(每滴溶液的体积相同) | 高锰酸钾溶液紫色褪去的时间 |
| 先滴入第1滴 | 1min |
| 褪色后再滴入第2滴 | 15s |
| 褪色后再滴入第3滴 | 3s |
| 褪色后再滴入第4滴 | 1s |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com