
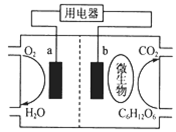
| A.该电池能够在高温下工作 | B.b电极发生还原反应 |
| C.O2在a电极被氧化 | D.电流从a电极经用电器流向b电极 |
科目:高中化学 来源:不详 题型:单选题
| A.手机上用的锂离子电池属于二次电池 |
| B.铜锌原电池工作时,电子沿外电路从铜电极流向锌电极 |
| C.氢氧燃料电池可把化学能转化为电能 |
| D.锌锰干电池中,锌电极是负极 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
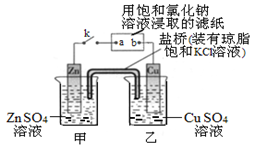
| A.Zn电极上发生还原反应 |
| B.片刻后盐桥中的Cl-向乙装置中移动 |
| C.片刻后在a点滴加酚酞观察到滤纸变红色 |
| D.片刻后在b点滴加淀粉碘化钾溶液观察到滤纸无变化 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
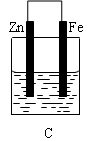
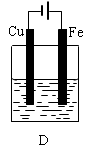
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
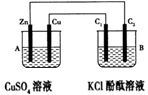
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
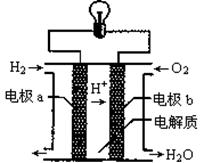
| A.该电池工作时将化学能转化为电能 |
| B.电流从电极b经外电路流向电极a |
| C.该电池中的电极b是正极 |
| D.在电极a上发生还原反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
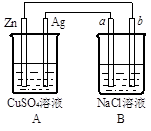
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
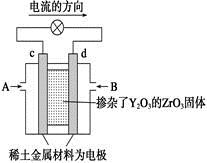
| A.c电极是正极,发生还原反应 |
| B.B口通入的是甲烷,发生氧化反应 |
| C.放电时O2-离子向d极移动 |
| D.d极上的电极反应式为:CH4+4O2-+8e-=CO2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 Al2O3 + 3H2↑,电解过程中,以下判断正确的是( )
Al2O3 + 3H2↑,电解过程中,以下判断正确的是( )| | 原电池 | 电解池 |
| A | H+移向Pb电极 | H+移向Pb电极 |
| B | 每消耗3molPb | 生成2molAl2O3 |
| C | 正极:PbO2+4H++2e-=Pb2++2H2O | 阳极:2Al+3H2O-6e-=Al2O3+6H+ |
| D | 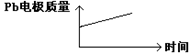 |  |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com