
| A. | 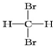 和 和 互为同分异构体 互为同分异构体 | |
| B. | 甲苯能使酸性高锰酸钾溶液褪色,能说明侧链对苯环性质有影响 | |
| C. | 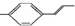 分子中所有碳原子可能都共面 分子中所有碳原子可能都共面 | |
| D. | 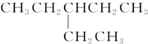 的核磁共振氢谱有5个峰 的核磁共振氢谱有5个峰 |
分析 A、甲烷中的四个氢原子是等效的,任何两个氢原子被卤素原子取代产物一样;
B、甲苯能使酸性高锰酸钾溶液褪色说明苯环对甲基影响;
C、分子中含有苯环和碳碳双键,结合苯、乙烯的结构特点来判断;
D、有机物中有几种等效氢原子就有几个峰.
解答 解:A、甲烷中的四个氢原子是等效的,任何两个氢原子被卤素原子取代产物一样,所以 和
和 是同种物质,故A错误;
是同种物质,故A错误;
B、甲苯能使酸性高锰酸钾溶液褪色说明苯环对甲基影响,故B错误;
C、分子中含有苯环和碳碳双键,具有苯、乙烯的结构特点,则两物质分子中所有碳原子可能处于同一平面上,故C正确;
D、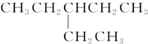 中有3种等效氢原子,3个峰,故D错误.
中有3种等效氢原子,3个峰,故D错误.
故选C.
点评 本题考查学生同分异构体的判断、原子共面以及等效氢原子的判断等知识,属于综合知识的考查,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 向水中加少量NaHSO4 | B. | 向水中加少量FeCl3 | ||
| C. | 向水中加少量Na2CO3 | D. | 将纯水加热到90℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
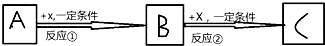
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 装置 | 药品 | 现象 | |
| 实验1 |  | 0.64g Cu片(0.01mol)和20.0mL浓HNO3 | Cu片消失,得到绿色溶液A,放置较长时间后得到蓝色溶液B,… |
| 操作 | 现象 | |
| 实验3 | i.配制与溶液A的c(H+)相同的HNO3溶液,取20.0mL,通入NO2气体 | 溶液呈黄色 |
| ii.再加0.01mol Cu(NO3)2固体搅拌至完全溶解 | 溶液变为绿色 | |
| 3、加水稀释 | 溶液立即变为蓝色 | |
| 实验4 | i.向20.0mL 0.5mol/L Cu(NO3)2蓝色溶液中通入少量NO2 | 溶液呈绿色 |
| ii.加入稀H2SO4 | 有无色气体放出,遇空气变红棕色,溶液很快变为蓝色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
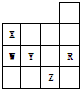
| A. | 常压下五种元素的单质中Z单质的沸点最高 | |
| B. | X和W的常见单质的分子式分别为X2和W2 | |
| C. | W的氢化物沸点比X的氢化物的沸点低 | |
| D. | R最高氧化物水化物的酸性最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
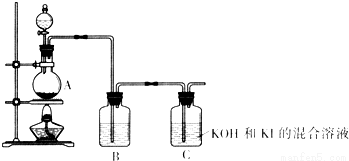
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com