
����Ŀ������ƽ����ϵ��a A(g)+b B(g)![]() c C(g)+d D(s) ��H��0�������ж�����ȷ����
c C(g)+d D(s) ��H��0�������ж�����ȷ����
A. ��(a+b) �� (c+d)����Ӧһ�����Է����ҽ���
B. ����ʼʱֻ����A��B�������ʵ���֮��Ϊa��b����ƽ��ʱA��B��ת����֮��Ϊa��b
C. ��a+b = c+d������m mol�����ƽ����ϵ�г���n mol B����ﵽƽ��ʱ���������ʵ������ڣ�m+n��mol��
D. ��a+b = c�������������������������¶ȣ�ƽ�������ƶ��������������ѹǿ����
���𰸡�D
��������A. DΪ��������(a+b)<(c+d)�����S��һ������0������G=��HT��S<0ʱ����Ӧ�����Է����У���A����B. ����ʼʱֻ����A��B����A��B�����ʵ���֮��Ϊa:b�����ݷ�Ӧ����ʽ��֪����Ӧ����������A��B�����ʵ���֮��Ҳ��a:b����ƽ��ʱA. B��ת����֮��Ϊ1:1����B����C. DΪ�������������г���n molB��ƽ��������Ӧ�����ƶ�������������ʵ�����С����ﵽƽ��ʱ���������ʵ���С��(m+n)mol����C����D. �÷�ӦΪ���ȷ�Ӧ�������¶�ƽ�������ƶ���a+b=c����Ӧǰ���������ʵ������䣬�ں��������£��¶�Խ��ѹǿԽ���������¶������������ѹǿ����D��ȷ����ѡD��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ȫ���������ʵ���Ũ�ȵ�NaCl��AlCl3��Һ�е�Cl�������ĵ����ʵ���Ũ�ȵ�AgNO3��Һ�������Ϊ1:1����������Һ�������Ϊ
A. 1:1 B. 9:1 C. 6:2 D. 3:1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���ܱ������У�ʢ��N2��H2 �� ���ǵ���ʼŨ�ȷֱ���1.8molL��1��5.4molL��1 �� ��һ�������������Ƿ�Ӧ����NH3 �� 10min����N2��Ũ����0.8molL��1 �� ������10min��NH3��ƽ����Ӧ�����ǣ� ��
A.0.1molL��1min��1
B.0.3molL��1min��1
C.0.2molL��1min��1
D.0.6molL��1min��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����ʵ������CO��H2�Ʊ�CH3OH����ԭ��Ϊ��CO��g��+2H2��g��CH3OH��g����H��0���¶��µĻ�ѧƽ�ⳣ������ʽ������298K��398Kʱ��ѧƽ�ⳣ���ֱ�ΪK1��K2 �� ��K1K2�������������������=����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������װ�ã��̶�װ����ȥ���������ȷ���ܴﵽʵ��Ŀ�ĵ���
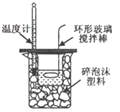
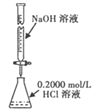
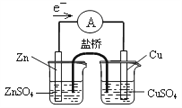
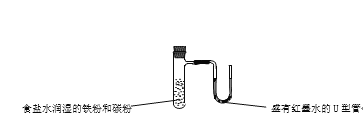
A. �к��ȵIJⶨ B. ����к͵ζ� C. ����ͭпԭ��� D. ģ�����ĸ�ʴ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵ����Ʋ���ȷ����
A.��ʯ�ࣺCaSO4��2H2OB.Ħ���Σ� (NH4)2Fe (SO4)2
C.��ͨ�����ijɷ֣�Na2O��CaO��6SiO2D.ľ����CH3OH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�ǵ��CuCl2��Һ��װ�ã�����c��dΪʯī�缫���������й��ж���ȷ���ǣ� �� 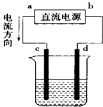
A.a������b����
B.d������c����
C.�������У�d�缫��������
D.�������У�������Ũ�Ȳ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��п���仯������;�㷺������п����п����Ҫ�ɷ���ZnS��Ϊ��Ҫԭ�ϣ��漰����Ҫ��Ӧ�У�
2ZnS(s) + 3O2(g) = 2ZnO(s) + 2SO2(g) ![]() H1=��930 kJ��mol��1
H1=��930 kJ��mol��1
2C(s) + O2(g) = 2CO(g) ![]() H2=��221 kJ��mol��1
H2=��221 kJ��mol��1
ZnO(s) + CO(g) = Zn(g) + CO2(g) ![]() H3=198 kJ��mol��1
H3=198 kJ��mol��1
��1����ӦZnS(s) + C(s) + 2O2(g) = Zn(g) + CO2(g) + SO2(g)��![]() H4=________kJ��mol��1����Ӧ�����ɵ�CO2��NH3��ϣ���һ�������·�Ӧ�ϳ����أ�
H4=________kJ��mol��1����Ӧ�����ɵ�CO2��NH3��ϣ���һ�������·�Ӧ�ϳ����أ�![]()
�÷�Ӧ��һ�����������Է����е�ԭ����_______�����÷�Ӧ��һ���¡������ܱ������ڽ��У��жϷ�Ӧ�ﵽƽ��״̬�ı�־��________��
a��CO2��H2O(g)Ũ����� b�������������ѹǿ���ٸı�
c��2v(NH3)�� = v(H2O)�� d�������л��������ܶȲ��ٸı�
��2������п�ɹ㷺����ӡȾýȾ����ľ�ķ�������ZnSO4���ȷֽ�����и��������ʵ������¶ȱ仯��ϵ��ͼ��ʾ��
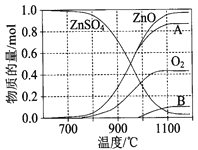
��д��700��~980��ʱ������Ӧ�Ļ�ѧ����ʽ��______________________________________________�� ����B�Ļ�ѧʽ��________________��
�� ����п�ֽ����ɵ�SO2����ͼ�е�����ѭ���ɷֱ�õ�S��H2SO4��д��ѭ��I�з�Ӧ2�Ļ�ѧ����ʽ��_____________________________________________��ѭ��II�е�����������Ӧʽ��_________________________________________��
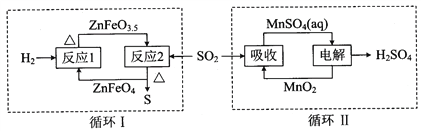
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪���·�У�������ͭ����a������ͼ��ʾ��װ�÷����������ǣ� �� 
A.��װ����Cu��Ϊ����
B.��ͭ���������仯Ϊ25.6gʱ��a�������ĵ�O2�ڱ�״���µ����Ϊ4.48L
C.b����Ӧ�ĵ缫��ӦʽΪ��H2��2e��=2H+
D.һ��ʱ���пƬ��������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com