
| 实验序号 | ① | ② | ③ | ④ |
| 盐酸体积/mL | 50 | 50 | 50 | 50 |
| 固体质量/g | 3.06 | 6.12 | 9.18 | 12.24 |
| 生成气体体积/L(标况) | 0.672 | 1.344 | 1.568 | 1.344 |
| A. | 盐酸的物质的量浓度为 2 mol•L-1 | |
| B. | 原混合物样品中 n(Na2CO3):n(KHCO3)=1:1 | |
| C. | 实验②中,混合物过量 | |
| D. | 实验④反应后,至少需继续加入 40ml 的该盐酸溶液才能把12.24g 的混合物全部反应 |
分析 A、根据④组盐酸完全反应求盐酸的浓度;
B、根据①、②计算样品中碳酸钠和碳酸氢钾的物质的量之比;
C、根据①②数据可知,固体质量扩大2 倍,生成气体的体积也扩大2倍;
D、由C可知还有0.06mol的碳酸氢根离子未完全反应,所以还需0.06mol的盐酸.
解答 解:A、根据④组固体质量12.24g,n(Na2CO3)为0.04mol,n(KHCO3)为0.08mol,碳酸钠首先转化为碳酸氢钠,消耗盐酸为:0.04mol,而碳酸氢根离子与盐酸反应生成二氧化碳1.344L,消耗盐酸为:0.06mol,所以盐酸的物质的量为0.06+0.04=0.1mol,c=$\frac{0.1mol}{50×1{0}^{-3}L}$=2 mol•L-1,故A正确;
B、设原混合物样品中 n(Na2CO3)为xmol,n(KHCO3)为ymol,则:$\left\{\begin{array}{l}{x+y=\frac{0.672}{22.4}}\\{106x+100y=3.06}\end{array}\right.$,解之得:$\left\{\begin{array}{l}{x=0.01}\\{y=0.02}\end{array}\right.$,原混合物样品中 n(Na2CO3):n(KHCO3)=1:2,故B错误;
C、根据①②数据可知,固体质量扩大2 倍,生成气体的体积也扩大2倍,所以混合物完全反应,故C错误;
D、由C可知还有0.06mol的碳酸氢根离子未完全反应,所以还需0.06mol的盐酸,V=$\frac{0.06}{2}$=0.03L,实验④反应后,至少需继续加入 30ml 的该盐酸溶液才能把12.24g的混合物全部反应,故D错误;
故选A.
点评 本题考查混合物的有关计算,难度中等,根据二氧化碳的体积变化判断盐酸是否完全反应式是关键,再根据气体体积与固体质量关系进行解答.


 全优测试卷系列答案
全优测试卷系列答案 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:多选题
| A. | 负极的电极反应式为Mg+2OH-+2e-═Mg(OH)2 | |
| B. | 电池放电时,OH-向负极移动 | |
| C. | 电解质溶液可以是稀H2SO4 | |
| D. | 正极的电极反应式为2MnO2+H2O+2e-═Mn2O3+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HF、HCl、HBr、HI的稳定性逐渐减弱 | |
| B. | C、N、O、F的最高正化合价逐渐增大 | |
| C. | KOH、NaOH、Mg(OH)2、Al(OH)3的碱性逐渐减弱 | |
| D. | SiH4、PH3、H2S、HCl的还原性逐渐减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molFeCl3跟沸水反应转化成氢氧化铁胶体后,生成胶体微粒的数目为NA | |
| B. | 电解精炼铜时,若转移了NA个电子,则阴极析出32 g铜 | |
| C. | 6.8克熔融的KHSO4中含有0.1NA个阳离子 | |
| D. | 标准状况下,11.2L四氯化碳所含分子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
 .元素⑤名称为Al在周期表中的位置第三周期ⅢA族.元素④与元素⑤最高价氧化物的水化物反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.
.元素⑤名称为Al在周期表中的位置第三周期ⅢA族.元素④与元素⑤最高价氧化物的水化物反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O. .
. ,该化合物属于离子(填“共价”或“离子”)化合物.
,该化合物属于离子(填“共价”或“离子”)化合物. ,
,查看答案和解析>>
科目:高中化学 来源: 题型:选择题
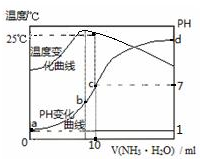
| A. | n=1.0 | |
| B. | 水的电离程度:b>c>a>d | |
| C. | c点:c(NH4+)=c(Cl-)=1.0mol•L-1 | |
| D. | 25℃时,NH4Cl的水解常数(Kh)=(n-1)×10-7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | LiH跟水反应后的溶液显中性 | B. | LiH在化学反应中是一种强氧化剂 | ||
| C. | LiH中氢离子可以被还原成氢气 | D. | LiH中氢离子半径比锂离子半径大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 人工分子筛(多孔硅铝酸盐)可以用作吸附剂和催化剂 | |
| B. | 硅胶可以用作食品、药品的干燥剂 | |
| C. | 利用风能、太阳能等能源代替化石燃料,有利于节约能源保护环境 | |
| D. | 蚕丝、腈纶和涤纶既属于化学纤维又属于高分子化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com