
 X、Y、Z、R为前四周期元素,且原子序数依次增大.XY2是红棕色气体;X与氢元素可形成XH3;Z基态原子的M层与K层电子数相等;R2+的3d轨道中有9个电子.
X、Y、Z、R为前四周期元素,且原子序数依次增大.XY2是红棕色气体;X与氢元素可形成XH3;Z基态原子的M层与K层电子数相等;R2+的3d轨道中有9个电子.- 2 |
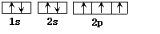 ;Z所在周期为第三周期,第一电离能同周期从左到右,呈增大趋势,即第一电离能最大的主族元素为:氯元素;Cu原子序数为29,其核外电子排布式为:1S22S22P63S23P63d104S1,即电子结构示意图为:
;Z所在周期为第三周期,第一电离能同周期从左到右,呈增大趋势,即第一电离能最大的主族元素为:氯元素;Cu原子序数为29,其核外电子排布式为:1S22S22P63S23P63d104S1,即电子结构示意图为: ;
; ;氯;
;氯; ;
;| 5+1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 8 |


科目:高中化学 来源: 题型:
| A、8.4 mL |
| B、5.6 mL |
| C、4.2 mL |
| D、2.8 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | ① | |||||||
| 2 | ② | ③ | ||||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:
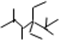 表示的分子名称是
表示的分子名称是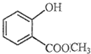 中含有的含氧官能团的名称为
中含有的含氧官能团的名称为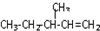 一定条件发生加聚反应时的化学方程式
一定条件发生加聚反应时的化学方程式查看答案和解析>>
科目:高中化学 来源: 题型:
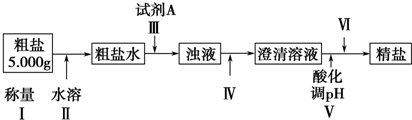
查看答案和解析>>
科目:高中化学 来源: 题型:
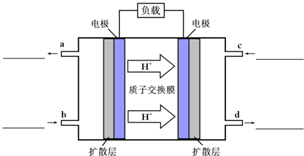 甲醇-空气燃料电池(DMFC)是一种高效能、轻污染电动汽车的车载电池,该燃料电池的电池反应式为:CH3OH(l)+
甲醇-空气燃料电池(DMFC)是一种高效能、轻污染电动汽车的车载电池,该燃料电池的电池反应式为:CH3OH(l)+| 3 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
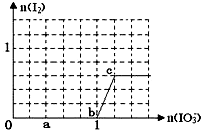 已知溶液中:还原性HSO3->I-,氧化性IO3->I2>SO42-.在含3molNaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如右图所示,试回答下列问题:
已知溶液中:还原性HSO3->I-,氧化性IO3->I2>SO42-.在含3molNaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如右图所示,试回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com