
【题目】根据下列实验过程,请回答:
(1)在常温下,将氯气通入氢氧化钠溶液中,所发生反应的离子方程式为:__;所得溶液具有漂白性,其有效成分的名称为__。
(2)将上述呈碱性的溶液与FeCl3溶液混合,可制得一种新型绿色消毒剂——高铁酸钠(Na2FeO4),反应如下:3ClO-+2Fe3++10OH-=2FeO42-+3Cl-+5H2O则该反应中的氧化产物是__(填离子符号),当反应中转移电子的数目是0.3NA时,所消耗的氧化剂的物质的量为__。
(3)证实最终所得溶液中含有Na+的操作是:进行焰色实验时,火焰呈现__色。
【答案】Cl2+2OH-=Cl-+ClO-+H2O 次氯酸钠 FeO42- 0.15mol 黄色
【解析】
(1)氯气通入氢氧化钠溶液反应生成氯化钠、次氯酸钠和水;次氯酸钠具有氧化性,可作漂白剂;
(2)3ClO-+2Fe3++10OH-=2FeO42-+3Cl-+5H2O反应中氯的化合价降低,得电子,被还原,铁元素的化合价升高被氧化,根据氧化还原反应化合价变化分析计算氧化剂的物质的量;
(3)钠元素在火焰上灼烧时的颜色为黄色。
(1)氯气通入氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,发生的离子反应为:Cl2+2OH-=Cl-+ClO-+H2O;次氯酸钠具有氧化性,可作漂白剂,所得溶液其有效成分的名称为次氯酸钠;
(2)3ClO-+2Fe3++10OH-=2FeO42-+3Cl-+5H2O反应中氯的化合价降低,得电子,被还原,ClO-作氧化剂,对应产物Cl-为还原产物,铁元素的化合价升高被氧化,Fe3+作还原剂,对应产物FeO42-为氧化产物,根据反应氯元素有+1价变为-1价,3mol ClO-参与反应转移6mol电子,当反应中转移电子的数目是0.3NA,即0.3mol时消耗氧化剂的物质的量=![]() =0.15mol;
=0.15mol;
(3)钠元素在火焰上灼烧时的颜色为黄色,证实最终所得溶液中含有Na+的操作是:进行焰色实验时,火焰呈现黄色。


科目:高中化学 来源: 题型:
【题目】用下列装置能达到实验目的的是
A. 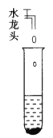 清洗铜与浓硫酸反应后有残液的试管
清洗铜与浓硫酸反应后有残液的试管
B. 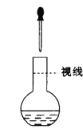 配置一定物质的量浓度的溶液实验中,为定容时的操作
配置一定物质的量浓度的溶液实验中,为定容时的操作
C. 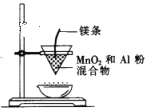 装置制取金属锰
装置制取金属锰
D. 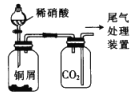 装置为制备并用排气法收集NO气体的装置
装置为制备并用排气法收集NO气体的装置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学工作者研发了一种 SUNCAT的系统,借助锂循环可持续,合成其原理如图所示。下列说法不正确的是
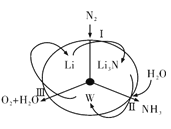
A. 过程I得到的Li3N的电子式为![]()
B. 过程Ⅱ生成W的反应为Li3N+3H2O=3LiOH+NH3↑
C. 过程Ⅲ涉及的阳极反应为4OH--4e-=O2↑+2H2O
D. 过程I、Ⅱ、Ⅲ均为氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示。下列说法正确的是
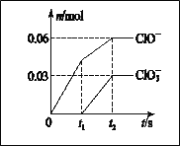
A. 苛性钾溶液中KOH的质量是4.94 g
B. 反应中转移电子的物质的量是0.09 mol
C. 氧化性ClO-<ClO3-
D. ClO3-的生成是由于温度升高引起的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验需要100mL、1.00mol/L的Na2CO3溶液,现通过如下操作配制:
①把称量好的固体Na2CO3放入小烧杯中,加适量蒸馏水溶解。
②把①所得溶液冷却到室温后,小心转入A;
③继续加蒸馏水至液面离瓶颈刻度线1~2cm处,改用B小心滴加蒸馏水至溶液凹液面最低点与刻度线相切;
④用少量蒸馏水洗涤玻璃棒和烧杯2~3次,每次洗涤的溶液都小心转入仪器A中,并轻轻摇匀;⑤将仪器A塞紧,充分摇匀。
(1)请书写操作②③所使用的仪器:A:____________、B:___________(填仪器名称)
(2)在仪器A上需标记的是___________________________________________
(3)操作步骤正确的顺序是____________________(填序号)。
(4)若所配溶液的密度为1.06g/mL,则该溶液的质量分数为_____________
(5)现用Na2CO3固体配制以上Na2CO3溶液,则需称量Na2CO3___________ g
(6)在配制100mL、0.1mol/L的Na2CO3溶液时,下列操作中的________会导致结果偏低(请用序号填写)。
a.用托盘天平称量时砝码放在左盘
b.将烧杯中的溶液转移到仪器A时不慎洒到仪器A外
c.定容时俯视刻度线
d.定容时仰视刻度线
e.干净的仪器A未经干燥就用于配制溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D四种物质均含有铁元素,彼此转化关系如下:

请回答:
(1)反应①称为铝热反应(属于置换反应),写出该反应的化学方程式:__、其中Al作__剂。
(2)反应④的离子方程式为:__。
(3)新配制的C溶液中应加入__,以防止其转化为D。检验D溶液中阳离子的常用试剂是__(填化学式),实验现象为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下在容积恒定的密闭容器中,进行可逆反应:A(g)+2B(g)![]() C(g)+D(g),当下列物理量不发生变化时,能表明该反应已达到该条件下的最大限度的是( )
C(g)+D(g),当下列物理量不发生变化时,能表明该反应已达到该条件下的最大限度的是( )
①容器内气体的压强
②混合气体的密度
③混合气体的平均相对分子质量
④v正(B)=2v逆(C)
A.只有④B.②③C.②③④D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A. ![]() 固体含有离子的数目为
固体含有离子的数目为![]()
B. 常温下,![]() 的醋酸溶液中H+数目为
的醋酸溶液中H+数目为![]()
C. 13g由![]() C和
C和![]() 组成的碳单质中所含质子数一定为
组成的碳单质中所含质子数一定为![]()
D. ![]() 与足量
与足量![]() 在一定条件下化合,转移电子数为
在一定条件下化合,转移电子数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究。
实验一:取等物质的量浓度等体积H2O2溶液分别进行下列实验,实验报告如下表所示。

序号 | 条件 | 现象 | 结论 | |
温度/℃ | 催化剂 | |||
1 | 40 | FeCl3溶液 | ||
2 | 20 | FeCl3溶液 | ||
3 | 20 | MnO2 | ||
4 | 20 | 无 | ||
(1)实验1、2的目的是研究__________因素对H2O2分解速率的影响。
(2)实验1对应的化学方程式为___________________________。
实验二:经研究知Cu2+对H2O2分解也具有催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,该小组的同学分别设计了如图所示的实验。可通过观察_________得出结论。 有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是____________________。
实验三:已知在高锰酸钾(KMnO4)酸性溶液和草酸(H2C2O4)溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显,但不久突然褪色,反应速率明显加快。
(1)写出硫酸酸化的高锰酸钾溶液和草酸溶液反应的化学方程式____________
(2)针对上述实验现象,某同学认为KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你的猜想还可能是______。
(3)若用实验证明你的猜想/span>,除酸性高锰酸钾溶液、草酸溶液试剂外,还需要选择的试剂最合理的是__________。
A、硫酸钾 B、硫酸锰 C、水 D、氯化锰
(4)若实验过程中将2.0mL0.10mol/LH2C2O4溶液与4.0mL0.010mol/L酸性KMnO4溶液混合(忽略溶液混合后体积的变化),测得溶液的褪色时间为40s,这段时间内平均反应速率v(KMnO4)=__________mol·L-1·min-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com