
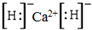 .
. ;D与E能形成一种非极性分子,该分子的结构式为S=C=S;D所在族元素的氢化物中,沸点最低的是H2S.
;D与E能形成一种非极性分子,该分子的结构式为S=C=S;D所在族元素的氢化物中,沸点最低的是H2S.分析 (1)融雪剂主要成分的化学式为XY2,X、Y均为周期表前20号元素,其阳离子和阴离子的电子层结构相同,含有相同的核外电子数,且1molXY2含有54mol电子,则阴、阳离子核外电子数为$\frac{54}{3}$=18,则为Ca2+、Cl-,故XY2是CaCl2,则X是Ca元素、Y是Cl元素;
(2)元素D、E原子的最外层电子数是其电子层数的2倍,D与氯元素相邻,则D为S元素;E有2个电子层,最外层电子数为4,则E为C元素;氢化物相对分子质量越大,沸点越高,含有氢键的沸点较高;
(3)元素W与Cl元素同周期,其单质是原子晶体,则W为Si元素;元素Z的单质分子Z2中有3个共价键,则Z为氮元素;
(4)元素R与Cl同族,其氢化物能用于刻蚀玻璃,则R为F元素;HF与二氧化硅反应生成四氟化硅和水;F2与NaOH溶液反应的产物之一是OF2,OF2中氧元素为+2,F元素为-1价,根据电荷守恒,还有NaF生成,根据元素守恒有水生成,据此配平书写.
解答 解:(1)融雪剂主要成分的化学式为XY2,X、Y均为周期表前20号元素,其阳离子和阴离子的电子层结构相同,含有相同的核外电子数,且1molXY2含有54mol电子,则阴、阳离子核外电子数为$\frac{54}{3}$=18,则为Ca2+、Cl-,故XY2是CaCl2;X是Ca元素,钙原子核外有20个电子,则Ca元素的原子核外电子有20种运动状态;则X是Ca元素、Y是Cl元素,X与氢元素形成的化合物的化学式是CaH2 ,氢化钙为离子化合物,钙失去2个电子给H原子,从而形成了H负离子,电子式为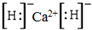 ;
;
故答案为:CaCl2;20;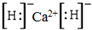 ;
;
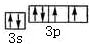
(2)元素D、E原子的最外层电子数是其电子层数的2倍,D与氯元素相邻,则D为硫元素,S原子的最外层的轨道表示式为 ;C与S形成的非极性分子为二硫化碳,其结构为S=C=S;氢化物相对分子质量越大,沸点越高,含有氢键的沸点较高,则第VIA族中S的氢化物的沸点最低,即H2S沸点最低;
;C与S形成的非极性分子为二硫化碳,其结构为S=C=S;氢化物相对分子质量越大,沸点越高,含有氢键的沸点较高,则第VIA族中S的氢化物的沸点最低,即H2S沸点最低;
故答案为: ;S=C=S;H2S;
;S=C=S;H2S;
(3)元素W与Cl元素同周期,其单质是原子晶体,则W为Si元素;元素Z的单质分子Z2中有3个共价键,则Z为氮元素,Si与N形成一种新型无机非金属材料为Si3N4,
故答案为:Si3N4;
(4)元素R与Cl同族,其氢化物能用于刻蚀玻璃,则R为F元素;HF与二氧化硅反应生成四氟化硅和水,其化学方程式为:4HF+SiO2=SiF4↑+2H2O;F2与NaOH溶液反应的产物之一是OF2,OF2中氧元素为+2,F元素为-1价,根据电荷守恒,还有NaF生成,根据元素守恒有水生成,反应离子方程式为:2F2+2OH-=2F-+OF2+H2O,
故答案为:4HF+SiO2=SiF4↑+2H2O;2F2+2OH-=2F-+OF2+H2O.
点评 本题考查位置结构性质相互关系及应用,侧重考查学生推断及知识运用能力,涉及电子式、元素周期律、化学键、离子方程式等知识点,正确判断元素是解本题关键,题目难度中等.


 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:选择题
| A. | 该反应为还原反应 | |
| B. | 上述反应中若产生0.1mol SO42-,则消耗SO2的物质的量为0.1mol | |
| C. | Fe2(SO4)3、品红两种溶液都能使上述反应进行 | |
| D. | 通入Cl2会增强SO2的漂白作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将该Na2CO3 溶液转移至250ml容量瓶中,加蒸馏水稀释至刻度线,摇匀 | |
| B. | 将该Na2CO3 溶液转移至250ml烧杯中,用量筒量取150ml蒸馏水加入,搅拌 | |
| C. | 将该Na2CO3 溶液转移至250ml烧杯中,用量筒量取400ml蒸馏水加入,搅拌 | |
| D. | 将该Na2CO3 溶液转移至500ml容量瓶中,加蒸馏水稀释至刻度线,摇匀 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 氧化性MnO4->IO3- | |
| B. | c=d=5,则该反应转移电子数为30e | |
| C. | 该反应的氧化产物只有IO3- | |
| D. | a、b、c、d之间的关系是:5a=2c+6d;b=2c+d |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com