
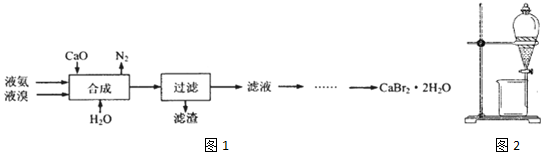
分析 制备溴化钙晶体的工艺流程:将液氨、液溴、CaO与水混合发生反应3CaO+3Br2+2NH3═3CaBr2+N2↑+3H2O、CaO+H2O=Ca(OH)2,过滤,滤渣为Ca(OH)2,滤液为CaBr2溶液,呈强碱性,其中含有少量BrO-、BrO3-,加热驱除多余的氨,用氢溴酸调节滤液呈酸性,加入活性炭脱色,用砂芯漏斗过滤,将滤液蒸发浓缩、冷却结晶、用砂芯漏斗过滤、用乙醇洗涤干净后,在真空干燥箱中干燥,得到CaBr2•2H2O晶体,据此分析作答.
解答 解:(1)实验室模拟海水提溴的过程中,用苯萃取溶液中的溴,分离溴的苯溶液与水层的操作是(装置如图2):使玻璃塞上的凹槽对准漏斗上的小孔,将活塞拧开,使下面的水层慢慢流下,待有机层和水层界面与活塞上口相切即关闭活塞,将上层液体从上口倒入另一烧杯中;
故答案为:将上层液体从上口倒入另一烧杯中;
(2)合成为液氨、液溴、CaO混合发生反应:3CaO+3Br2+2NH3═3CaBr2+N2↑+3H2O;其中液溴、液氨易挥发,故合成过程温度不能过高;投料时控制n(Br2):n(NH3)=1:0.8,确保Br2被充分还原;
故答案为:3CaO+3Br2+2NH3═3CaBr2+N2↑+3H2O;温度过高,Br2、NH3易挥发;确保Br2被充分还原;
(3)合成反应中:CaO+H2O=Ca(OH)2,故滤渣为:Ca(OH)2;
故答案为:Ca(OH)2;
(4)滤液为CaBr2溶液,呈强碱性,其中含有少量BrO-、BrO3-,加热驱除多余的氨,用氢溴酸调节滤液呈酸性,加入活性炭脱色,用砂芯漏斗过滤,将滤液蒸发浓缩、冷却结晶、用砂芯漏斗过滤、用乙醇洗涤干净后,在真空干燥箱中干燥,得到CaBr2•2H2O晶体;
故答案为:用氢溴酸调节滤液呈酸性,加入活性炭脱色,用砂芯漏斗过滤,将滤液蒸发浓缩、冷却结晶、用砂芯漏斗过滤、用乙醇洗涤干净后,在真空干燥箱中干燥.
点评 本题考查了物质的制备,涉及对工艺流程的理解、氧化还原反应、对条件的控制选择与理解等,理解工艺流程原理是解题的关键,是对学生综合能力的考查,需要学生具备扎实的基础与灵活运用能力,题目难度中等.


科目:高中化学 来源: 题型:解答题
 .(不考虑空间构型)
.(不考虑空间构型)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCOOH 和 CH3COOH 互为同系物 | |
| B. | 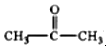 与CH3CH2CHO互为同分异构体 与CH3CH2CHO互为同分异构体 | |
| C. | 质子数为35、中子数为45的溴原子:${\;}_{35}^{80}$Br | |
| D. | 烷烃CH3CH(CH3)C(CH3)3的名称是2,3,3-三甲基丁烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 现象 | 结论 |
| A | 向蔗糖中加入浓硫酸 | 蔗糖变成疏松多孔的海绵状 | 浓硫酸具有吸水性和强氧化性 |
| B | 将0.1mol/LMgSO4溶液滴入NaOH溶液至不再有沉淀产生,再滴加0.1mol/LCuSO4溶液 | 先有白色沉淀生成后变为浅蓝色沉淀 | Cu(OH)2的溶解度比Mg(OH)2的小 |
| C | FeCl3和BaCl2混合溶液中通入足量SO2 | 溶液变为浅绿色且有白色沉淀生成 | Fe3+被还原为Fe2+,沉淀为BaSO3 |
| D | 常温下,将铁片浸入足量浓硫酸中 | 铁片上无明显现象 | 常温下,铁与浓硫酸没有发生化学反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜跟稀HNO3反应:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O | |
| B. | 向硫酸铝溶液中加入过量氨水:Al3++3OH-═AlO2-+2H2O | |
| C. | 向Ag(NH3)2NO3溶液中加入盐酸:Ag(NH3)2+2H+═Ag++2NH4+ | |
| D. | NaHSO4溶液和Ba(OH)2溶液混合后溶液呈中性:Ba2++OH-+H++SO42-═BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  用图装置加热氯化铵溶液制取氯化铵晶体 | |
| B. | 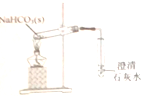 用图装置探究NaHCO3的热稳定 | |
| C. |  用图装置溶解氯化钠配制100mL1mol•L-1NaCl溶液 | |
| D. |  用图装置比较硫、碳、硅三种元素的非金属性强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{17}^{35}$Cl与 ${\;}_{17}^{37}$Cl得电子能力不相同 | |
| B. | 核外电子排布相同的微粒化学性质也相同 | |
| C. | Cl-、S2-、Ca2+、K+半径逐渐减小 | |
| D. | 同主族元素含氧酸的酸性随核电荷数的增加而减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将20mL0.1mol/L氯化锂溶液和20mL0.1mol/LNa2CO3溶液混合后,观察到有白色沉淀生成 | |
| B. | 硼的最高价氧化物对应的水化物是硼酸,硼酸属于弱酸 | |
| C. | Be(OH)2既能溶于强酸,又能溶于强碱溶液 | |
| D. | Be属于金属,Be能与盐酸反应产生氢气,但不能与NaOH溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙三醇、乙二醇的水溶液的凝固点很低,乙二醇可作内燃机的抗冻剂,丙三醇用于配制化妆品 | |
| B. | 丙三醇的沸点比乙二醇的沸点高 | |
| C. | 这两种多元醇均易溶于乙醇,难溶于水 | |
| D. | 乙二醇和丙三醇都能与Na发生反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com