
【题目】正确表示下列反应的离子反应方程式为
A.向FeBr2溶液中通入足量氯气:2Fe2++4Br﹣+3Cl2═2 Fe3++2 Br2+6Cl﹣
B.向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42﹣沉淀完全:![]()
C.![]() 稀溶液与过量的KOH溶液反应:
稀溶液与过量的KOH溶液反应:![]()
D.醋酸除去水垢:![]()
【答案】A
【解析】
A. FeBr2溶液中通入足量氯气,反应生成氯化铁和溴,反应的离子方程式为:2Fe2++4Br﹣+3Cl2═2 Fe3++2 Br2+6Cl﹣,故A正确;
B. 明矾溶液中滴加Ba(OH)2溶液,恰好使SO42﹣沉淀完全,铝离子转化成偏铝酸根离子,正确的离子方程式为:2Ba2++4OH﹣+Al3++2SO42﹣═2BaSO4↓+AlO2﹣+2H2O,故B错误;
C. NH4HCO3溶于过量的NaOH溶液,生成碳酸钠、一水合氨、水,正确的离子反应为:NH4++HCO3﹣+2OH﹣═CO32﹣+H2O+NH3H2O,故C错误;
D. 醋酸和碳酸钙都需要保留化学式,正确的离子方程式为:CaCO3+2CH3COOH=Ca2++H2O+CO2↑+2CH3COO﹣,故D错误;
故选A。


 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源: 题型:
【题目】下图是一种正投入生产的大型蓄电系统,放电前,被膜隔开的电解质为Na2S2和NaBr3,放电后分别变为Na2S4和NaBr。下列叙述正确的是( )
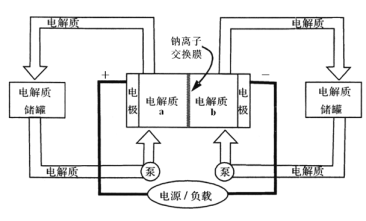
A. 放电时,负极反应为3NaBr-2e-=NaBr3+2Na+
B. 充电时,阳极反应为2Na2S2-2e-=Na2S4+2Na+
C. 放电时,Na+经过离子交换膜,由b池移向a池
D. 用该电池电解饱和食盐水,产生2.24 L H2时,b池生成17.40gNa2S4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用酸性氢氧燃料电池为电源进行电解的实验装置示意图如图所示。下列说法正确的是( )

A.燃料电池工作时,正极反应为O2+2H2O+4e-=4OH-
B.此装置用于铁表面镀铜时,a为铁b为Cu,工作一段时间要使右池溶液复原可加入适量的CuO
C.a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出
D.若a、b两极均为石墨时,在相同条件下,a极产生的气体与电池中消耗的H2体积相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在温度一定的条件下,N2(g)+ 3H2(g)![]() 2NH3(g)在密闭容器中反应并达到平衡时,混合气体的平均摩尔质量为
2NH3(g)在密闭容器中反应并达到平衡时,混合气体的平均摩尔质量为![]() ,N2与NH3的浓度均为c mol·L1。若将容器的体积压缩为原来的1/2,当达到新的平衡时,下列说法中不正确的是
,N2与NH3的浓度均为c mol·L1。若将容器的体积压缩为原来的1/2,当达到新的平衡时,下列说法中不正确的是
A.新的平衡体系中,N2的浓度小于2c mol·L1大于c mol·L1
B.新的平衡体系中,NH3的浓度小于2c mol·L1大于c mol·L1
C.新的平衡体系中,混合体的平均摩尔质量大于![]()
D.新的平衡体系中,气体密度是原平衡体系的2倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述及解释正确的是
A. 2NO2(g)(红棕色)![]() N2O4(g)(无色) ΔH<0,在平衡后,对平衡体系采取缩小容积、增大压强的措施,因为平衡向正反应方向移动,故体系颜色变浅
N2O4(g)(无色) ΔH<0,在平衡后,对平衡体系采取缩小容积、增大压强的措施,因为平衡向正反应方向移动,故体系颜色变浅
B. 对于C(s) + O2(g) ![]() 2CO(g) ,在平衡后,加入碳,平衡向正反应方向移动
2CO(g) ,在平衡后,加入碳,平衡向正反应方向移动
C. FeCl3+3KSCN![]() Fe(SCN)3(红色)+3KCl,在平衡后,加少量KCl,因为平衡向逆反应方向移动,故体系颜色变浅
Fe(SCN)3(红色)+3KCl,在平衡后,加少量KCl,因为平衡向逆反应方向移动,故体系颜色变浅
D. 对于N2+3H2![]() 2NH3,平衡后,压强不变,充入O2,平衡向逆方向移动
2NH3,平衡后,压强不变,充入O2,平衡向逆方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学欲通过实验验证氯元素的非金属性强于硫元素。
(1)他们将过量硫粉与少量铁粉混合后隔绝空气加热,制得并分离出固体产物A。请帮他们完成实验报告。
实验步骤和操作 | 实验现象 | 实验结论或解释 |
①取少量A于试管中,加入足量稀硫酸 | 固体完全溶解,产生有臭鸡蛋气味的气体B | 硫粉与铁粉混合后隔绝空气加热,制得固体产物A是__________(填化学式) |
②将B通入足量水中 | 得到无色溶液C | |
③向①的试管中加入KSCN溶液 | 溶液无明显变化 | |
④将浓盐酸滴到KMnO4固体上 | 产生黄绿色气体 | 反应生成氯气 |
⑤将红热的铁丝(少量)伸入上述黄绿色气体中 | 铁丝剧烈燃烧,产生大量棕黄色的烟 | 反应的化学方程式为__________ |
⑥将⑤中所得固体产物溶于水,在所得溶液中滴加KSCN溶液 | 观察到___________(填现象) |
(2)综合上述实验现象和结论,___________(填“能”或“不能”)验证氯元素的非金属性强于硫元素,理由是_____________________________________。
(3)某同学将上述实验中④所得氯气直接通入无色溶液C中,观察到产生淡黄色固体,反应的化学方程式为_______________,此实验______________(填“能”或“不能”)验证氯元素的非金属性强于硫元素。
(4)某同学认为将步骤①中的稀硫酸换成稀盐酸,若同样产生有臭鸡蛋气味的气体B,则可以说明氯元素的非金属性强于硫元素,他的观点____________(填“正确”或“错误”),原因是_____________。
(5)现有四种试剂:A.新制的Cu(OH)2;B.浓硝酸;C.AgNO3溶液;D.碘水。为了鉴别下列三瓶无色溶液,请你选择合适的试剂,将其序号填入相应的括号中。(每个小题只有一个正确答案):
①葡萄糖溶液_____________②淀粉溶液_____________③鸡蛋清溶液____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠硫电池作为一种新型储能电池,其应用逐渐得到重视和发展。钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2SX)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图1所示:


(1)根据表数据,请你判断该电池工作的适宜应控制
在_____(填字母)范围内。
A.100℃以下 B.100~300℃
C.300~350℃ D.350~2050℃
物质 | Na | S | Al2O3 |
熔点/℃ | 97.8 | 115 | 2050 |
沸点/℃ | 892 | 444.6 | 2980 |
(2)放电时,电极A为_____极,电极B发生_____反应(填“氧化或还原”)。
(3)充电时,总反应为Na2Sx=2Na+xS,则阳极的电极反应式为:________________。
(4)若把钠硫电池作为电源,电解槽内装有KI及淀粉溶液如图2所示,槽内的中间用阴离子交换膜隔开。通电一段时间后,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅。则右侧发生的电极方程式:________________;试分析左侧溶液蓝色逐渐变浅的可能原因是:___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
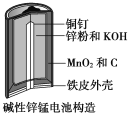
【题目】碱性锌锰电池是日常生活中消耗量最大的电池,其构造如图所示。放电时总反应为:Zn+2H2O+2MnO2=Zn(OH)2+2MnOOH。
从废旧碱性锌锰电池中回收Zn和MnO2的工艺如图所示:
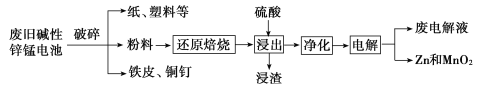
回答下列问题:
(1)MnOOH中,Mn元素的化合价为_________。
(2)“还原焙烧”过程中,高价金属化合物被还原为低价氧化物或金属单质(其中MnOOH、MnO2被还原成MnO),主要原因是“粉料”中含有_________。
(3)“净化”是为了除去浸出液中的Fe2+,方法是:加入______(填化学式)溶液将Fe2+氧化为Fe3+,再调节pH使Fe3+沉淀完全。常温下,已知浸出液中Mn2+、Zn2+的浓度约为0.1 mol/L,根据下列数据计算,调节pH的合理范围是______至__________。(离子浓度小于1×10-5 mol/L即为沉淀完全)
化合物 | Mn(OH)2 | Zn(OH)2 | Fe(OH)3 |
Ksp近似值 | 10-13 | 10-17 | 10-38 |
(4)“电解”时,阳极的电极反应式为_________。本工艺中应循环利用的物质是_______(填化学式)。
(5)若将“粉料”直接与盐酸共热反应后过滤,滤液的主要成分是ZnCl2和MnCl2,且生成一种黄绿色气体,“粉料”中的MnOOH与盐酸反应的化学方程式为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com