
【题目】在冶金工业上,均需用电解法才能得到的一组金属是( )
A.Na、Mg B.Na、Zn C.Cu、Ag D.Mg、Fe
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:
【题目】把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后,产生1.16g白色沉淀,再向所得浊液中逐渐加入1.00mol/LHCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示。
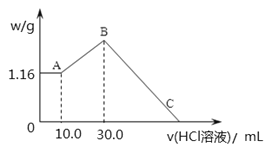
①A点的沉淀物的化学式为 。
②写出A点至B点发生反应的离子方程式: 。
③原混合物中NaOH的质量是 g,C点(此时沉淀恰好完全溶解)HCl溶液的
体积为 mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以冶铝的废弃物铝灰为原料制取超细α氧化铝,既降低环境污染又可提高铝资源的利用率。已知铝灰的主要成分为Al2O3(含少量杂质SiO2、FeO、Fe2O3),其制备实验流程如下:
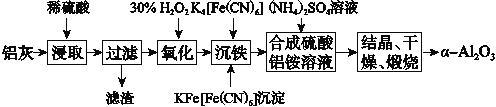
(1)铝灰中氧化铝与硫酸反应的化学方程式为__________________________。
(2)图中“滤渣”的主要成分为________(填化学式)。
(3)加30% H2O2溶液发生反应的离子方程式为_________________________。
(4)煅烧硫酸铝铵晶体,发生的主要反应为
4[NH4Al(SO4)2·12H2O]2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O,将产生的气体通过如图所示的装置。

①集气瓶中收集到的气体是________(填化学式)。
②足量饱和NaHSO3溶液吸收的物质除大部分H2O(g)外还有________(填化学式)。
③KMnO4溶液褪色(MnO被还原为Mn2+),发生反应的离子方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏伽德罗常数,下列叙述正确的是( )
A.0.1 mol丙烯酸中含有双键的数目为0.1NA
B.标准状况下,11.2 L苯中含有分子的数目为0.5NA
C.1 mol甲苯含有6nA个C—H键
D.丙烯和环丙烷组成的42 g混合气体中氢原子的个数为6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:碘单质能与I-反应成I3-,并在溶液中建立如下平衡:I2+I![]() I3-。通过测平衡体系中c(I2)、c(I-)和c(I3-),就可求得该反应的平衡常数。某同学为测定上述平衡体系中C(I2),采用如下方法:取V1mL平衡混合溶液,用cmolL-1的Na2S2O3溶液进行滴定(反应为I2+2Na2S2O3=2NaI+Na2S4O6),消耗V2mL的Na2S2O3溶液。根据V1、V2和c可求得c(I2)。下列对该同学设计方案的分析,正确的是
I3-。通过测平衡体系中c(I2)、c(I-)和c(I3-),就可求得该反应的平衡常数。某同学为测定上述平衡体系中C(I2),采用如下方法:取V1mL平衡混合溶液,用cmolL-1的Na2S2O3溶液进行滴定(反应为I2+2Na2S2O3=2NaI+Na2S4O6),消耗V2mL的Na2S2O3溶液。根据V1、V2和c可求得c(I2)。下列对该同学设计方案的分析,正确的是
A.方案可行,能准确测定溶液中的c(I2)
B.方案可行,可采用淀粉做该滴定反应的指示剂
C.不可行,只能测得溶液中c(I2)与c(I3-)之和
D.不可行,因为I-能与Na2S2O3溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学—选修3:物质结构与性质]四川含有丰富的矿产资源,钒矿、钛矿、黄铁矿等七种矿产储量位居全国第1位。回答下列问题:
(1)V2O5常用作SO2 转化为SO3的催化剂。SO2 分子中键角 120°(填“>”、“<”或“=”);SO3分子中S原子的杂化轨道类型为 ;V2O5 溶解在NaOH溶液中,可得到钒酸钠(Na3VO4),该盐阴离子的立体构型为 。
(2)VO2+在酸性条件下可被草酸(H2C2O4)还原为VO2+,草酸被氧化为CO2,该反应用于钒含量的测定。写出反应的离子方程式 。
(3)钛在元素周期表中的位置为 ,其电子排布式为 。用乙醚从TiCl3的饱和溶液中萃取可得TiCl3·6H2O绿色晶体,其配位数为6,将1mol该晶体加入到足量硝酸银溶液中可得2mol白色沉淀,则该配合物的化学式是 。
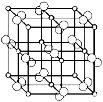
(4)科学家通过X射线探明,黄铁矿(FeS2)的晶体结构与NaCl的晶体结构相似,若在FeS2晶体中阴阳离子间最近距离为a cm,阿伏伽德罗常数为NA。则晶体密度表达式为 g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
物 质 | 熔点(℃) | 沸点(℃) | 密度(g/cm3) |
乙 醇 | -117.0 | 78.0 | 0.79 |
乙 酸 | 16.6 | 117.9 | 1.05 |
乙酸乙酯 | -83.6 | 77.5 | 0.90 |
浓硫酸(98%) | —— | 338.0 | 1.84 |
某学生在实验室制取乙酸乙酯的主要步骤如下:
①在30mL的大试管A中按体积比1:4:4的比例配制浓硫酸、乙醇和乙酸的混合溶液。
②按如图1所示连接好装置(装置气密性良好),用小火均匀地加热装有混合溶液的大试管5~10分钟
③待试管B收集到一定量产物后停止加热,撤出试管B并用力振荡,然后静置,等待分层.
④分离出乙酸乙酯层并洗涤、干燥。
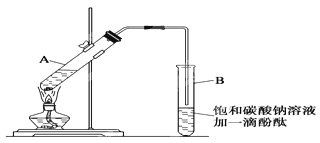
请根据题目要求回答下列问题:
(1)配制该混合溶液的主要操作步骤为:______,写出制取乙酸乙酯的化学方程式:______.
(2)上述实验中饱和碳酸钠溶液的作用是:______(填字母)。
A.中和乙酸和乙醇
B.中和乙酸并吸收部分乙醇
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于其分层析出
D.加速酯的生成,提高其产率
(3)步骤②中需要小火均匀加热,其主要理由是:______。
(4)指出步骤③所观察到的现象:______;分离出乙酸乙酯层后,一般用饱和食盐水和饱和氯化钙溶液洗涤,可通过洗涤除去______(填名称)杂质;为了干燥乙酸乙酯,可选用的干燥剂为______(填字母)。
A.P2O5B.无水Na2SO4C.碱石灰 D.NaOH固体
(5)某化学课外小组设计了如下图所示的制取乙酸乙酯的装置(图中的铁架台、铁夹、加热装置已略去),与上图的装置相比,下图装置的主要优点有:____________、_________。(写出两条即可)

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com