
【题目】将足量NO2通入下列各溶液中,所含离子还能大量共存的是( )
A.Fe2+、CH3COO﹣、SO42﹣、Na+
B.Ca2+、K+、Cl﹣、HCO3﹣
C.NH4+、Al3+、NO3﹣、Cl﹣
D.K+、Na+、SO32﹣、AlO2﹣
科目:高中化学 来源: 题型:
【题目】不用其他试剂,用最简单的方法一一鉴别出下列物质:①NaOH溶液,②Mg(NO3)2溶液,③CuSO4溶液,④KCl溶液,正确的鉴别顺序是( )
A.①②③④ B.③①②④
C.④①②③ D.③④②①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中,既能与盐酸反应又能与NaOH溶液反应的是( )
①NaHCO3 ②Al2O3 ③Al(OH)3 ④NaAlO2 ⑤Al
A.②③ B.②③⑤ C.①②③⑤ D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌是一种应用广泛的金属,目前工业上主要采用“湿法”工艺冶炼锌,某硫化锌精矿的主要成分是ZnS (还含有少量FeS等其它成分),以其为原料冶炼锌的工艺流程如图所示:
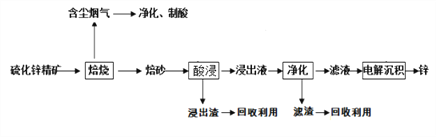
回答下列问题:
(1)硫化锌精矿的焙烧在氧气气氛的沸腾炉中进行,所产生焙砂的主要成分的化学式为___________。浸出液净化过程中加入的主要物质是锌粉,其作用是___________。
(2)电解沉积过程中的阴极采用铝板,阳极采用情性电极,阳极的电极反应式是______________。
(3)在该流程中可循环使用的物质是Zn和_________。
(4)改逬的锌冶炼工艺,采用了“氧压酸浸”的全湿法流程,既省略了易导致空气污染的焙烧过程,又可获得一种有工业价值的非金属单质,“氧压酸浸”中发生主要反应的离子方程式为_________________。
(5)硫化锌精矿(ZnS )遇到硫酸铜溶液可慢慢的转化为铜蓝(CuS)。请解释该反应发生的原理____________________________。
(6)我国古代曾采用“火法”工艺冶炼锌。明代宋应星著的《天工开物》中有关于“升炼倭铅”的记载:“炉甘石十斤,装载入一尼罐内,……,然后逐层用煤炭饼垫盛,其底铺薪,发火锻红,….,冷淀,毀罐取出,…即倭铅也。”该炼锌工艺主要反应的化学方程式为__________________________
(注:炉甘石的主要成分为碳酸锌,倭铅是指金属锌)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜灰渣(含有Cu、Zn、CuO、ZnO及少量的FeO、Fe2O3)生产氯化铜晶体的流程如下:

(1)反应Ⅰ中所加Zn粉不能过量的原因是______________________
(2)滤液Ⅱ中含有的主要金属阳离子是___________________
(3)写出反应Ⅱ的化学方程式_________________________
(4)“系列操作”包括蒸发浓缩、冷却结晶、过滤、__________、___________。
(5)在空气中直接加热CuCl2·xH2O晶体得不到纯的无水CuCl2,原因是____________________(用化学方程式表示)
(6)CuCl2·xH2O晶体中x值的测定:称取3.420g产品溶解于适量水中,向其中加入含AgNO3 4.400×10-2mol的AgNO3溶液(溶液中除Cl- 外,不含其它与Ag+反应的离子),待Cl- 完全沉淀后,用含Fe3+的溶液作指示剂,用0.2000 mol·L-1的KSCN标准溶液滴定剩余的AgNO3。使剩余的Ag+以AgSCN白色沉淀的形式析出。
①滴定终点的现象是______________________。
②若滴定过程用去上述浓度的KSCN标准溶液20.00mL,则CuCl2·xH2O 中x值为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠( NaCl02)是一种高效氧化剂和漂白剂,主要用于棉纺、纸张漂白、食品消毒、水处理等。已知:NaClO2饱和溶液在温度低于38 ℃时析出的晶体是NaClO2![]() 3H2O,高于38 ℃时析出晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。纯ClO2易分解爆炸。一种制备亚氯酸钠粗产品的工艺流程如下:
3H2O,高于38 ℃时析出晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。纯ClO2易分解爆炸。一种制备亚氯酸钠粗产品的工艺流程如下:

(1) ClO2发生器中的离子方程式为 ,发生器中鼓人空气的作用可能是__________(选填序号)。
a.将SO2氧化成SO3,增强酸性
b.稀释ClO2以防止爆炸
c.将NaClO3还原为ClO2
(2)吸收塔内反应的化学方程式为 ,吸收塔的温度不能超过20℃,其原因是_____________。
(3)从“母液”中可回收的主要物质是 。
(4)从吸收塔中可获得NaCl02溶液,从NaCl02溶液到粗产品(NaClO2)经过的操作步骤依次为:①减压,55℃蒸发结晶;② ;③ ;④低于60℃干燥,得到成品。
(5)为测定粗品中NaCl02的质量分数,做如下实验:
准确称取所得亚氯酸钠样品10.00 g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴人适量的稀硫酸,充分反应(ClO2-+ 4I-+ 4H+= 2H2O+ 2I2+ Cl-)。将所得混合液配成250mL待测溶液,取25.00 mL待测液,用2.000 mol.L-lNa2S203标准液滴定(I2+2S2O32-= 2I-+S4O62-),测得消耗Na2SO3溶液平均值为16.40mL。该样品中NaClO2的质量分数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关非金属元素说法正确的是( )
A.二氧化氯具有还原性,可用于自来水的杀菌消毒
B.液氨汽化时要吸收大量的热,可用作制冷剂
C.硫具有还原性,可用硫粉覆盖地上洒落的汞
D.硅是重要的半导体材料,常用于制作光导纤维
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平;②2CH3CHO+O2![]() 2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。回答下列问题:
2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。回答下列问题:

(1)A的结构简式为____________________________。
(2)写出B、D化合物中官能团的名称:B______;D______.
(3)写出下列反应的反应类型:①________,②__________
(4)写出反应①的化学方程式____________________。
(5)写出反应②的化学方程式____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中用字母标出的元素,回答下列问题(用化学用语表示):
![]()
(1)在这些元素中,化学性质最不活泼的是____________,其原子结构示意图为____________。元素K是____________,在周期表中的位置是__________________。
(2)最高价氧化物对应水化物中碱性最强的化合物是______________。
(3)某元素二价阳离子的核外有10个电子,该元素是__________。
(4)G、H、I形成的简单气态氢化物稳定性由强到弱的顺序是______________________________。
(5)F、H、J的最高价氧化物对应水化物的酸性由强到弱的顺序是______________________。
(6)I、J、K三种元素形成的离子,离子半径由大到小的顺序是________________________。
(7)元素I的氢化物的结构式为________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com