
【题目】Ⅰ、实验室可以用KMnO4固体和浓盐酸反应制取少量Cl2,反应的化学方程式为:2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O回答下列问题:
(1)该反应中被氧化的元素是__________.
(2)氧化性:KMnO4__________Cl2(填“>”、“<”或“=”)
(3)该反应中氧化剂和氧化产物的物质的量之比为__________.
(4)用双线桥法表示该反应中电子转移的方向和数目:_________
2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O
(5)每生成标准状况下2.24L Cl2,反应中转移电子的物质的量为__________.
Ⅱ、实验室常用以下方法制取氯气:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O请你根据所学知识回答下列问题:
MnCl2+Cl2↑+2H2O请你根据所学知识回答下列问题:
(1)把氯气通入紫色石蕊试液中,可以观察到的现象是:________________,请你解释其中的原因 __________________________________________________
(2)为保证实验安全,常用NaOH溶液吸收多余的氯气。写出反应的化学方程式__________________________________;
【答案】 Cl > 2:5 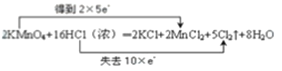 0.2mol 先变红后褪色 氯气和溶液中的水反应生成盐酸和次氯酸,石蕊遇酸变红色;同时次氯酸有漂白性,把变红色的石蕊漂白所以后褪色 Cl2+2NaOH=NaCl+NaClO+H2O
0.2mol 先变红后褪色 氯气和溶液中的水反应生成盐酸和次氯酸,石蕊遇酸变红色;同时次氯酸有漂白性,把变红色的石蕊漂白所以后褪色 Cl2+2NaOH=NaCl+NaClO+H2O
【解析】Ⅰ、(1)HCl中的Cl元素化合价由-1价升高到0价,被氧化,所以被氧化的元素为Cl。
(2)KMnO4是氧化剂,Cl2是氧化产物,氧化剂的氧化性大于氧化产物的氧化性,所以氧化性:KMnO4>Cl2。
(3)KMnO4全部做氧化剂,氧化产物是HCl,所以氧化剂和氧化产物的物质的量之比为2:5。
(4)反应中KMnO4为氧化剂,Mn元素的化合价由+7价降低到+2价,得到5个电子,Cl元素化合价由-1价升高到0价,被氧化,当有2molKMnO4参加反应,转移电子10mol,则电子转移的方向和数目用双线桥法表示如下: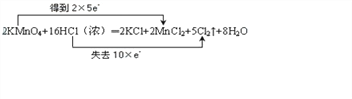 。
。
(5)每生成1molCl2转移2mol电子,标准状况下2.24L Cl2的物质的量为0.1mol,所以转移的电子的物质的量为0.1![]() 2mol=0.2mol。
2mol=0.2mol。
Ⅱ、(1) 氯气与水反应生成HCl和HClO,溶液呈酸性,紫色石蕊试液变红,HClO具有漂白性,把变红色的石蕊漂白。答案为:先变红后褪色、、氯气和溶液中的水反应生成盐酸和次氯酸,石蕊遇酸变红色,同时次氯酸有漂白性,把变红色的石蕊漂白所以后褪色。
(2)氯气有毒,不能随意排放,实验室常常用NaOH溶液吸收,发生的化学方程式为:Cl2+2NaOH=NaCl+NaClO+H2O。


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】化学兴趣小组学生用如图所示的装置探究苯和液溴的反应并制备溴苯. 
请分析后回答下列问题:
(1)关闭F夹,打开C夹,向装有少量苯的三颈烧瓶的A口加少量液溴,再加入少量铁屑,塞住A口,则三颈烧瓶中发生反应的化学方程式 .
(2)D试管内出现的现象为 .
(3)E试管内出现的现象为 .
(4)三颈烧瓶右侧导管特别长,除导气外还起的作用是 .
(5)反应结束后将三颈烧瓶中的溴苯分离实验方法是 . (铁屑已分离)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应能用离子方程式H++OH-=H2O表示的是( )
A. Ba(OH)2和H2SO4 B. KOH和NaHSO4
C. Cu(OH)2和HNO3 D. KOH和醋酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列:①H2O ②H2O2③Ba(OH)2④Na2O2⑤Cl2⑥Ar⑦CO2等物质填空. (1﹣4小题填序号)
(1)由离子键和非极性键构成的是
(2)由极性键和非极性键构成的是
(3)不存在化学键的是
(4)离子化合物有
(5)写出Na2O2的电子式:
(6)CO2分子中碳原子采用杂化.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知PH3与NH3结构相似,回答下列问题: ①PH3的电子式 , 结构式 .
②几何构型为 .
③中心原子采取杂化.
④PH3分子中的化学键(填“有”或“无”)极性,其分子为(填“极性”或”非极性”)分子.
⑤PH3与NH3的热稳定性:更强.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示中,A是一种常见的单质,B、C、D、E是含A元素的常见化合物,它们的焰色反应的火焰均呈黄色。

填写下列空白:
(1)写出化学式:A_____,B_____,D______________。
(2)以上反应中属于氧化还原反应的有_____(填序号)。
(3)写出反应⑤的离子方程式:___。写出反应⑥的化学方程式:___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com