
【题目】按要求写出方程式.
(1)碳酸氢铵溶液中加入过NaOH溶液,并加热(写出离子方量程式) .
(2)已知4℃时四种化合物在水中和液氨中的溶解度如表:
AgNO3 | Ba(NO3)2 | AgCl | BaC12 | |
H2O (液) | 170g | 9.2g | 1.5×10﹣4g | 33.3g |
NH3(液) | 86g | 97.2g | 0.8g | 0g |
上述四种物质在水中形成复分解反应的离子方程式为 , 在液氨中发生复分解反应的化学方程式为 .
【答案】
(1)NH4++HCO3﹣+2OH﹣ ![]() NH3↑+CO32﹣+2H2O
NH3↑+CO32﹣+2H2O
(2)Ag++Cl﹣=AgCl↓;Ba(NO3)+2AgCl=2AgNO3+BaCl2↓
【解析】解:(1)NH4HCO3溶液与足量NaOH溶液混合加热的离子反应为:NH4++HCO3﹣+2OH﹣ ![]() NH3↑+CO32﹣+2H2O,故答案为:NH4++HCO3﹣+2OH﹣
NH3↑+CO32﹣+2H2O,故答案为:NH4++HCO3﹣+2OH﹣ ![]() NH3↑+CO32﹣+2H2O;(2)由溶解度表可知,在水中AgCl不溶于水,在液氨中氯化钡不溶,则水中硝酸银与氯化钡发生复分解反应,反应的离子方程式为:Ag++Cl﹣=AgCl↓;
NH3↑+CO32﹣+2H2O;(2)由溶解度表可知,在水中AgCl不溶于水,在液氨中氯化钡不溶,则水中硝酸银与氯化钡发生复分解反应,反应的离子方程式为:Ag++Cl﹣=AgCl↓;
液氨中硝酸钡与氯化银发生复分解反应,反应的离子方程式为:Ba(NO3)+2AgCl=2AgNO3+BaCl2↓,
故答案为:Ag++Cl﹣=AgCl↓;Ba(NO3)+2AgCl=2AgNO3+BaCl2↓.
(1)氢氧化钠过量,铵根离子和碳酸氢根离子都参加反应,加热条件下生成碳酸钠、氨气和水.(2)由溶解度表可知,在水中AgCl不溶于水,在液氨中氯化钡不溶,则
水中硝酸银与氯化钡发生复分解反应;液氨中硝酸钡与氯化银发生复分解反应.


科目:高中化学 来源: 题型:
【题目】含A元素的一种单质是一种重要的半导体材料,含A元素的一种化合物C可用于制造高性能的现代通讯材料﹣﹣光导纤维,C与烧碱反应生成含A元素的化合物D.
(1)写出C与HF的化学方程式是 .
(2)将C与纯碱混合高温熔融时也发生化学反应生成D,同时还生成B的最高价氧化物E;将全部的E与全部的D在足量的水中混合后,又发生化学反应生成含A的化合物F.
①写出生成F的化学方程反应方程式: .
②要将纯碱高温熔化,下列坩埚中可选用的是 .
A、普通玻璃坩埚B、石英玻璃坩埚C、氧化铝坩埚D、铁坩埚
(3)100gC与石灰石的混合物充分反应后,生成的气体在标准状况下的体积为11.2L,100g混合物中石灰石的质量分数是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】榄香烯是一种新型的抗癌药,它的结构简式如图,有关说法正确的是( ) 
A.榄香烯的分子式为C15H20
B.榄香烯属于芳香烃
C.1 mol 榄香烯最多能和3 mol H2反应
D.榄香烯不能使酸性高锰酸钾溶液和溴的四氯化碳溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组用如图1装置进行实验,试回答下列问题. 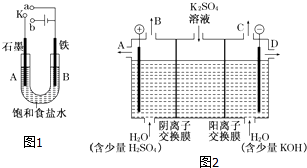
(1)若开始时开关K与a连接,则B极的电极反应式为 .
(2)若开始时开关K与b连接,则B极的电极反应式为 , 有关上述实验,下列说法正确的是(填序号) . ①溶液中Na+向A极移动
②从A极处逸出的气体能使湿润的KI淀粉试纸变蓝
③反应一段时间后通入适量HCl可恢复到电解前电解质的浓度
④若标准状况下B极产生2.24L气体,则溶液中转移0.1mol电子
(3)该小组同学认为,如果模拟工业上离子交换膜法制烧碱的方法,那么可以设想用如图2装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾. ①该电解槽的阳极反应式为 . 此时通过阴离子交换膜的离子数(填“大于”、“小于”或“等于”)通过阳离子交换膜的离子数.
②制得的氢氧化钾溶液从出口(填写“A”、“B”、“C”或“D”)导出.
③若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池,则电池正极的电极反应式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是 ( )
A. 烧碱、纯碱、熟石灰均属于碱,稀豆浆、FeCl3溶液、蛋白质溶液均属于胶体
B. SO2、NO2、CO2等非金属氧化物都是酸性氧化物
C. 碱性氧化物一定是金属氧化物,金属氧化物不一定是碱性氧化物
D. 葡萄糖溶液和淀粉溶液的本质区别是能否产生丁达尔效应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com