
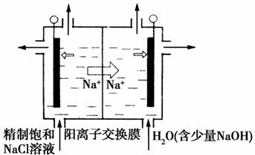
 二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂.目前已开发出用电解法制取ClO2的新工艺.
二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂.目前已开发出用电解法制取ClO2的新工艺.| 离子 | Cu2+ | H+ | Cl- | SO42- |
| c/mol•L-1 | 1 | 4 | 4 | 1 |
分析 (1)①阳极发生氧化反应,由题意可知,氯离子放电生成ClO2,由元素守恒可知,有水参加反应,结合电荷守恒可知,同时生成氢离子;
②在阴极发生反应:2H++2e-=H2↑,根据n=$\frac{V}{{V}_{m}}$计算氢气的物质的量,通过阳离子交换膜的阳离子为+1价离子,根据电子转移守恒计算阳离子的物质的量;
(2)根据原电池原理,正极O2得到电子生成负极O2-;
(3)依据电解原理和溶液中离子放电顺序,结合电子守恒和电极反应计算得到.
解答 解:(1)①阳极发生氧化反应,由题意可知,氯离子放电生成ClO2,由元素守恒可知,有水参加反应,结合电荷守恒可知,同时生成氢离子,阳极电极反应式为:Cl--5e-+2H2O=ClO2↑+4H+,
故答案为:Cl--5e-+2H2O=ClO2↑+4H+;
②在阴极发生2H++2e-=H2↑,氢气的物质的量为$\frac{0.112L}{22.4L/mol}$=0.005mol,通过阳离子交换膜的阳离子为+1价离子,故交换膜的阳离子的物质的量为0.005mol×2=0.01mol,故答案为:0.01;
(2)燃料电池,电池的一个电极通 入空气,另一个电极通入甲醇气体,电解质是掺入了 Y2O3的ZrO2晶体,在高温下它能传导O2-离子,根据原电池原理,正极O2得到电子生成负极O2-:O2+4e-=2O2-,故答案为:O2+4e-=2O2-;
(3)电解一段时间后,当两极收集到相同体积(相词条件)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象),100ml溶液中含有c(Cu2+)=1mol/L,c(H+)=4mol/L,c(Cl-)=4mol/L,c(SO42-)=1mol/L;
阳极氯气和阴极氢气相同,设阳极生成的氧气物质的量为x,阴极上也应生成氢气物质的量x
阳极电极反应为:2Cl--2e-=Cl2↑,4OH--4e-=2H2O+O2↑,
0.4mol 0.4mol 0.2mol 4x x
阴极电极反应为:Cu2++2e-=Cu,
0.1mol 0.2mol 0.1mol
2H++2e-=H2↑; 2H++2e-=H2↑;
0.4mol 0.4mol 0.2mol 2x x
依据电子守恒0.4+4x=0.2+0.4+2x
x=0.1mol
阳极上收集到氧气的物质的量0.1mol;
故答案为:0.1.
点评 本题考查了原电池和电解池原理的分析应用,氧化还原反应的实质,掌握原理是解题关键,题目难度中等.


科目:高中化学 来源: 题型:多选题
| A. | 由不同种元素原子形成的共价键 | |
| B. | 由同种元素的两个原子形成的共价键 | |
| C. | 分子中必定含有极性键 | |
| D. | 共同电子对必然偏向吸引电子能力强的原子一方 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
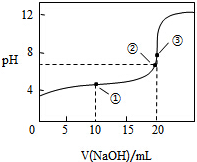 常温下,用0.1000mol•L-1 NaOH溶液滴定20.00mL0.1000mol•L-1 CH3COOH溶液所得滴定曲线如图,下列说法不正确的是( )
常温下,用0.1000mol•L-1 NaOH溶液滴定20.00mL0.1000mol•L-1 CH3COOH溶液所得滴定曲线如图,下列说法不正确的是( )| A. | 点③溶液显碱性的原因是 CH3COO-+H2O═CH3COOH+OH- | |
| B. | 点②时溶液中c(Na+)大于c(CH3COO-) | |
| C. | 点①溶液中 c(CH3COOH)+c(H+)>c(CH3COO-)+c(OH-) | |
| D. | 在逐滴加入NaOH溶液至40mL的过程中,水的电离程度先增大后减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$先增大再减小 | |
| B. | c(NH4+)与c(NH3•H2O)之和始终保持不变 | |
| C. | 水的电离程度始终增大 | |
| D. | 当加入CH3COOH的体积为10mL时,c(NH4+)=c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将10 mL该溶液稀释至100 mL后,pH=4 | |
| B. | 向该溶液中加入等体积pH为12的氨水恰好完全中和 | |
| C. | 该溶液中盐酸电离出的c(H+)与水电离出的c(H+)之比为1010:1 | |
| D. | 该溶液中由水电离出的c(H+)水×c(OH-)水=1×10-14 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ⑤
⑤ ⑧
⑧ ⑨
⑨ .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C3H8、C4H8、C4H6 | B. | CH4、C3H6、C2H2 | C. | C2H6、C3H6、C4H6 | D. | C2H4、CH4、C3H4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com