
根据下表中部分短周期元素的原子半径及主要化合价信息:
元素代号 | L | M | Q | R | T |
原子半径/nm | 0.130 | 0.118 | 0.090 | 0.102 | 0.073 |
主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
请判断以下叙述正确的是( )
A.氢化物的沸点为H2T<H2R B. L2+与R2-的核外电子数相等
C.与稀盐酸反应单质Q比单质L快 D.M与T形成的化合物具有两性
科目:高中化学 来源:2013-2014安徽省淮南市下学期期末考试高一化学试卷(解析版) 题型:选择题
金刚石和石墨是碳元素的两种结构不同的单质。在100kPa时,1mol石墨转化为金刚石,要吸收1.895kJ的热能。据此,试判断在100kPa压强下,下列说法正确的是( )
A.金刚石比石墨稳定 B.石墨转化为金刚石属于化学变化
C.1mol石墨比1mol金刚石的总能量高 D.石墨和金刚石是碳元素的同位素
查看答案和解析>>
科目:高中化学 来源:2013-2014安徽省、合肥六中第二学期期末联考高二化学试卷(解析版) 题型:选择题
下列各表述与示意图一致的是
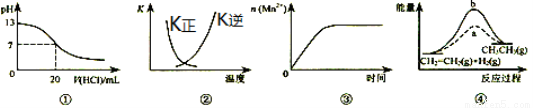
A.图①表示25℃时,用0.1mol?L-1盐酸滴定20mL0.1mol?L-1NaOH溶液,溶液的pH随加入酸体积的变化
B.图②曲线表示反应2SO2(g)+O2(g)  2SO3(g);△H﹤0正、逆反应的平衡常数K随温度的变化
2SO3(g);△H﹤0正、逆反应的平衡常数K随温度的变化
C.图③表示10mL0.01mol?L-1KMnO4酸性溶液与过量的0.1mol?L-1H2C2O4溶液混合时,n(Mn2+)随时间的变化
D.图④中a、b曲线分别表示反应CH2=CH2(g)+H2(g)→CH3CH3(g);△H<0使用和未使用催化剂时,反应过程中的能量变化
查看答案和解析>>
科目:高中化学 来源:2013-2014安徽省、合肥六中第二学期期末联考高二化学试卷(解析版) 题型:选择题
下列分子中,所有原子的最外层均为8电子结构的是
A.BeCl2 B.H2S C.NCl3 D.SF6
查看答案和解析>>
科目:高中化学 来源:2013-2014安徽省、合肥六中第二学期期末联考高一化学试卷(解析版) 题型:选择题
用下列实验装置进行的实验中,不能达到相应实验目的的是 ( )

A.装置甲:气体从b口进入,收集CO2 B.装置乙:可制得金属锰
C.装置丙:实验室制取乙酸乙酯 D.装置丁:验证HCl气体在水中的溶解性
查看答案和解析>>
科目:高中化学 来源:2013-2014安徽省、合肥六中第二学期期末联考高一化学试卷(解析版) 题型:选择题
XY2是由短周期元素形成的化合物,Y-比X2+多一个电子层,且与氩原子的电子层结构相同。下列有关叙述不正确的是( )
A.X是第二周期元素 B.Y是第ⅦA族元素
C.Y-与X2+的最外层电子数相同 D.化合物XY2的化学键为离子键
查看答案和解析>>
科目:高中化学 来源:2013-2014安徽省、合肥六中第二学期期末联考高一化学试卷(解析版) 题型:选择题
下列化学用语正确的是( )
A.氯化钠的电子式 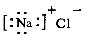 B.乙烯的结构简式CH2CH2
B.乙烯的结构简式CH2CH2
C.磷原子的结构示意图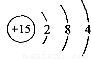 D.乙酸的分子式C2H4O2
D.乙酸的分子式C2H4O2
查看答案和解析>>
科目:高中化学 来源:2013-2014宁夏银川市高三第二次模拟考试理综化学试卷(解析版) 题型:实验题
(14分)
氢溴酸在工业和医药领域中有着广泛的用途,下图是某兴趣小组模拟工厂制备氢溴酸粗品并精制的流程如下:
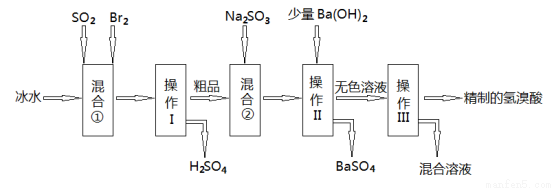
(1)混合①使用冰水的目的是 ;
(2)操作II和III的名称是 , ;
(3)混合②中发生反应的离子方程式为 ;
(4)工业上用氢溴酸和大理石制得溴化钙中含有少量Al3+、Fe3+杂质,加入适量的试剂 (填化学式)后控制溶液的PH约为8.0即可除去杂质,控制溶液的PH约为8.0的目的是_______________________________________________________;
(5)t℃时,将HBr通入AgNO3溶液中生成的AgBr在水中的沉淀溶解平衡曲线如图所示,又知t℃时AgCl的Ksp=4×l0-10,下列说法不正确的是 ( )
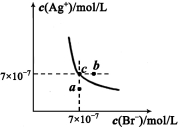
A.向含有Cl- 和Br- 的混合液中滴加硝酸银溶液,一定先产生AgBr的沉淀
B.在AgBr饱和溶液中加入NaBr固体,可使溶液由c点到b点
C.图中a点对应的是AgBr的不饱和溶液
D.在t℃时,AgCl(s)+Br-(aq) AgBr(s)+Cl-(aq)平衡常数Κ≈816
AgBr(s)+Cl-(aq)平衡常数Κ≈816
查看答案和解析>>
科目:高中化学 来源:2013-2014宁夏高一下学期期中考试化学试卷(解析版) 题型:填空题
(6分,每空2分)下图表示的是在800℃时,含有A、B、C三种气体的体系中各物质浓度随时间变化的情况,请回答:
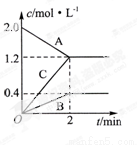
(1)该反应的反应物是 。
(2)该反应的化学方程式是 。
(3)若达到平衡状态的时间为2min,则A物质的平均反应速率为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com