
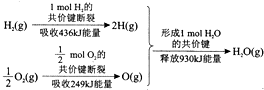
| A. | 1molH2(g)的共价键形成放出436kJ能量 | |
| B. | 氢气跟氧气反应生成水的同时吸收能量 | |
| C. | 1molH2(g)跟$\frac{1}{2}$molO2(g)反应生成1molH2O(g)释放能量245kJ | |
| D. | 1molH2(g)与$\frac{1}{2}$molO2(g)的总能量大于1molH2O(g)的能量 |
分析 该图表示了1mol氢气和0.5mol氧气反应生成1mol水的过程中的能量变化,断键吸收能量,成键释放能量,△H=反应物键能和-生成物键能和,据此解答.
解答 解:△H=反应物键能和-生成物键能和=436kJ/mol+249kJ/mol-930kJ/mol=-245kJ/mol
A.1molH2(g)的共价键形成放出436kJ能量,故A正确;
B.氢气燃烧生成水是放热反应,反应过程中放出热量,故B错误;
C.1molH2(g)跟$\frac{1}{2}$molO2(g)反应生成1molH2O(g)释放能量245kJ,故C正确;
D.该反应放热,反应物的总能量大于生成物的总能量,1molH2(g)与$\frac{1}{2}$molO2(g)的总能量大于1molH2O(g)的能量,故D正确;
故选B.
点评 本题考查了氢气和氧气生成水的过程中的能量变化,注意△H=反应物键能和-生成物键能和,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 1.6 g | B. | 2.0 g | C. | 0.01 mol | D. | 2.5 g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20℃5 mL 0.1 mol•L-1的Na2S2O3溶液,10mL 0.1 mol•L-1的H2SO4溶液,5mL H2O | |
| B. | 20℃5 mL 0.2mol•L-1的Na2S2O3溶液,5 mL 0.2 mol•L-1的H2SO4溶液,10mLH2O | |
| C. | 30℃5mL0.1 mol•L-1的Na2S2O3溶液,10mL 0.1 mol•L-1的H2SO4 溶液,5mLH2O | |
| D. | 30℃5 mL0.2 mol•L-1的Na2S2O3溶液,5 mL 0.2 mol•L-1的H2SO4溶液,10mL H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
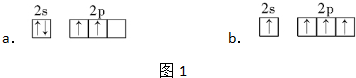
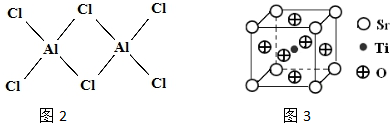
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
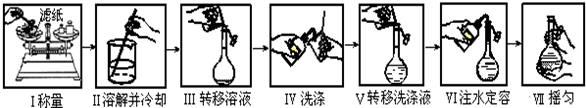
| A. | 如图是精确配制一定物质的量浓度NaOH溶液的实验步骤,其中操作正确的有4步 | |
| B. | 苯的硝化实验三种溶液混合过程中,应先在试管中加入浓硝酸,再沿试管壁缓慢加入浓硫酸混合均匀,冷却到50℃以下,再在不断振荡下逐滴加入苯 | |
| C. | 1mol•L-1CuSO4溶液2mL和0.5mol•L-1NaOH溶液4mL混合后加入40%的乙醛溶液0.5mL,加热煮沸观察沉淀的颜色 | |
| D. | 在试管中加入2mL硝酸银溶液,然后加入几滴NaCl溶液,再加入几滴KI溶液,可以观察到白色沉淀变成黄色沉淀,可以说明AgI的KSP小于AgCl的KSP |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
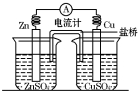 将锌片、铜片、盐桥、导线、电流计和ZnSO4溶液、CuSO4溶液连接成如图装置,下列各叙述中正确的是( )
将锌片、铜片、盐桥、导线、电流计和ZnSO4溶液、CuSO4溶液连接成如图装置,下列各叙述中正确的是( )| A. | 构成原电池,锌片作正极 | |
| B. | 铜片附近Cu2+离子浓度减小 | |
| C. | 锌片上有铜析出,铜片上没有 | |
| D. | 导线中电流的方向是由锌片流向铜片 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com