
| ||
| ||
| ||
| ||
| ||
| ||


科目:高中化学 来源: 题型:
| A、加入铝粉能产生H2的溶液中可能大量共存的离子组:NH4+、Fe2+、SO42-、NO3- |
| B、碳酸氢钠溶液中离子浓度的大小关系c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-) |
| C、碳酸钠溶液中离子浓度的关系2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
| D、向Ca(ClO)2溶液中通入少量CO2的离子方程式:2ClO-+CO2+H2O═2HClO+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加热 |
| B、用98%的浓硫酸代替稀硫酸 |
| C、滴加少量硫酸铜溶液 |
| D、不用铁片改用铁粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、离子化合物中只存在离子键,没有共价键 |
| B、构成单质分子的粒子中一定含有共价键 |
| C、共价化合物分子中一定不存在离子键 |
| D、仅由非金属元素组成的化合物中一定不含离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
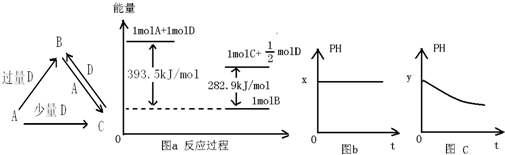
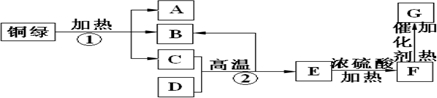
查看答案和解析>>
科目:高中化学 来源: 题型:
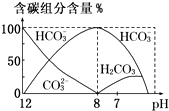 在含有弱电解质的溶液中,往往有多个化学平衡共存.
在含有弱电解质的溶液中,往往有多个化学平衡共存.| c(CH3COO-)?c(H+) |
| c(CH3COOH) |
c(HC
| ||
c(C
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| 方案 | 反应物 |
| 甲 | Cu、浓HNO3 |
| 乙 | Cu、稀HNO3 |
| 丙 | Cu、O2、稀HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| KMnO4/H+ |
| 浓H2SO4 |
| △ |
 nCH=CH+nCH=CH
nCH=CH+nCH=CH| 催化剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com