
分析 (1)利用盖斯定律,1式加2式的二倍即可得到该方程式及焓变;
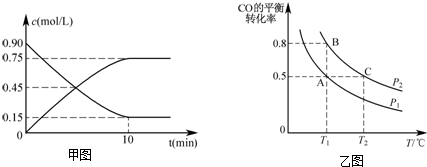
(2)根据反应速率v=$\frac{△c}{△t}$,结合物质表示的反应速率之比等于物质前边的系数之比来计算;
(3)①平衡标志是正逆反应速率相同,各成分浓度保持不变分析判断选项;
②正反应方向为气体体积减小的方向,T1℃时比较CO的转化率,转化率越大,则压强越大;
③A、B反应温度相等,则平衡常数相等,利用平衡常数计算;
(4)①燃料电池总反应是燃料燃烧的化学方程式,在碱性环境下,二氧化碳转化为碳酸根离子,据此书写;
②当有0.5mol甲醇参与反应时,产生的二氧化碳是0.5mol,和0.8mol氢氧化钾反应,根据元素守恒可以计算n (K2CO3)=0.3mol,n (KHCO3)=0.2mol,据此确定离子浓度的大小顺序.
解答 解:(1)已知①2CH4(g)+O2(g)=2CO(g)+4H2(g)△H=a KJ/mol
②CO(g)+2H2(g)=CH3OH(g)△H=b KJ/mol,①+②×2可得到2CH4(g)+O2(g)=2CH3OH(g)△H=(a+2b)kJ/mol,故答案为:2CH4(g)+O2(g)=2CH3OH(g)△H=(a+2b)kJ/mol;
(2)用甲醇表示的反应速率v=$\frac{0.75mol/L}{10min}$=0.075mol/(L•min),氢气表示的反应速率是甲醇的2倍,即0.15mol/(L•min),故答案为:0.15mol/(L•min);
(3)A.H2的消耗速率等于CH3OH的生成速率的2倍,不能说明正逆反应速率相等,不一定平衡,故A错误;
B.H2的体积分数不再改变是化学平衡的特征,达到了平衡,故B正确;
C.体系中H2的转化率和CO的转化率相等,不能说明正逆反应速率相等,不一定平衡,故C错误;
D.体系中气体的平均摩尔质量等于质量和物质的量的比值,物质的量变化,质量不变,所以当体系中气体的平均摩尔质量不再改变,证明达到了平衡,故D正确.
故选BD.
②正反应方向为气体体积减小的方向,T1℃时比较CO的转化率,转化率越大,则压强越大,图象中PB转化率大于PA,可知PA<PB,故答案为:<;
③A、B两容器温度相同,即化学平衡常数相等,且B点时CO的转化率为0.8,
则 CO(g)+2H2(g)?CH3OH(g)
起始(mol):10 20 0
转化(mol):8 16 8
平衡(mol):2 4 8
设体积为VL,则有K=$\frac{\frac{8}{V}}{\frac{2}{V}•(\frac{4}{V})^{2}}$=4,V=4L,
故答案为:4L;
(4)①燃料电池总反应是燃料燃烧的化学方程式,在碱性环境下,二氧化碳转化为碳酸根离子,即2CH3OH+3O2+4OH-=2CO32-+6H2O,
故答案为:2CH3OH+3O2+4OH-=2CO32-+6H2O;
②当有0.5mol甲醇参与反应时,产生的二氧化碳是0.5mol,和0.8mol氢氧化钾反应,根据元素守恒可以计算n (K2CO3)=0.3mol,n (KHCO3)=0.2mol,二者的水溶液均为碱性,所以C(K+)>C(CO32-)>C(HCO3-)>C(OH-)>C(H+),
故答案为:C(K+)>C(CO32-)>C(HCO3-)>C(OH-)>C(H+).
点评 本题主要考查了热化学方程式的书写、化学平衡状态的判断、平衡的计算以及燃料电池中电极反应的书写和溶液中离子浓度的大小比较知识,属于综合知识的考查,难度大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题
 X、Y、Z、W、R、T是元素周期表前四周期常见元素,且原子序数依次增大,其相关信息如下表:
X、Y、Z、W、R、T是元素周期表前四周期常见元素,且原子序数依次增大,其相关信息如下表:| 元素 | 相关信息 |
| X | 元素最高正价与最低负价的绝对值相等 |
| Y | 是地壳中含量最多的元素 |
| Z | 元素基态原子3p能级只有一个电子 |
| W | 与Z位于同周期,能量最高的p 能级电子为半充满 |
| R | 单质为黄色固体,常存在于火山喷发口 |
| T | 元素基态原子核未成对电子最多 |
| 第一电离能 | 离子半径 | 离子还原性 | 最高价氧化物的熔点 |
| W>R | Y>Z | Y<R | X<Z |
 (或
(或 ).
).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
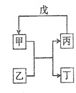 甲、乙、丙、丁、戊的相互转化关系如图所示(反应条件略去,箭头表示一步转化).下列各组物质中,不满足图示转化关系的是( )
甲、乙、丙、丁、戊的相互转化关系如图所示(反应条件略去,箭头表示一步转化).下列各组物质中,不满足图示转化关系的是( )| 选项 | 甲 | 乙 | 丙 | 戊 |
| A | NH3 | O2 | NO | H2O |
| B | Fe | H2O | H2 | Fe2O3 |
| C | Al(OH)3 | NaOH溶液 | NaAlO2溶液 | 过量CO2 |
| D | Na2O2 | CO2 | O2 | Na |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇、次氯酸钠溶液均可以将病毒氧化而达到消毒的目的 | |
| B. | 高锰酸钾溶液和双氧水的消毒原理相同 | |
| C. | 双氧水具有较强的腐蚀性,不能用于清洗创口 | |
| D. | 在次氯酸钠溶液中通入少量二氧化硫可得到亚硫酸钠和次氯酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
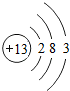 ,Al(OH)3的碱性比Mg(OH)2弱(填“强”或“弱”).
,Al(OH)3的碱性比Mg(OH)2弱(填“强”或“弱”). .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 四氯化碳的电子式 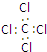 | B. | 乙炔的最简式 CH≡CH | ||
| C. | 聚乙烯的结构简式为 CH2=CH2 | D. | 丙烷的分子结构模型示意图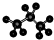 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
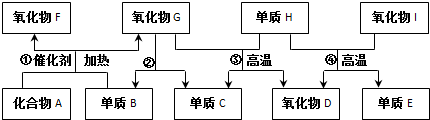
 .氧化物I中化学键类型:共价键.组成E单质的元素在元素周期表中的位置是第三周期第ⅣA族.图中物质所含元素原子的半径由大到小依次是(写元素符号)Si、C、N、O、H.
.氧化物I中化学键类型:共价键.组成E单质的元素在元素周期表中的位置是第三周期第ⅣA族.图中物质所含元素原子的半径由大到小依次是(写元素符号)Si、C、N、O、H. N2O4.
N2O4.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙炔和丁炔 | B. | 乙烷和丁烷 | C. | 苯和甲苯 | D. | 乙炔和苯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com