
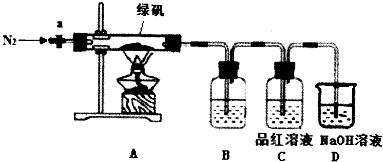
分析 II.(1)亚铁离子易被空气中氧气氧化为铁离子,加入过量铁粉可以防止亚铁离子被氧化;
(2)用热水预热过滤器及趁热过滤是为了减少晶体的损失;
III.(3)①充分分解后,A处试管中固体物质完全变为红棕色说明生成氧化铁;
②结合原子守恒分析分解产物,品红溶液褪色是二氧化硫气体;
③依据氧化还原反应电子守恒分析,FeSO4中铁元素与硫元素物质的量之比为1:1,电子转移铁元素+2价变化为+3价,硫元素化合价+6价变化为+4价,还剩余+6价化合物为三氧化硫,检验该氧化物利用三氧化硫溶于水生成硫酸,加入氯化钡溶液生成沉淀设计实验检验;
④反应物为硫酸亚铁结晶水合物晶体受热分解生成氧化铁、二氧化硫、三氧化硫和水,结合原子守恒配平书写化学方程式.
解答 解:II.(1)亚铁离子易被空气中氧气氧化为铁离子,加入过量铁粉可以防止亚铁离子被氧化,铁粉需要过量的原因是防止Fe2+被氧化,
故答案为:防止Fe2+被氧化;
(2)用热水预热过滤器及趁热过滤是为了减少晶体的损失,防止晶体在滤纸上析出,影响产量,
故答案为:防止晶体在滤纸上析出,影响产量;
III.(3)①充分分解后,A处试管中固体物质完全变为红棕色说明生成氧化铁;
②结合原子守恒分析分解产物,品红溶液褪色是二氧化硫气体,
故答案为:SO2;
③依据氧化还原反应电子守恒分析,FeSO4中铁元素与硫元素物质的量之比为1:1,电子转移铁元素+2价变化为+3价,硫元素化合价+6价变化为+4价,还剩余+6价化合物为三氧化硫,检验该氧化物利用三氧化硫溶于水生成硫酸,加入氯化钡溶液生成沉淀设计实验检验,
a.二氧化硫溶于水也可以使紫色石蕊试液变红色,故a错误;
b.NaHCO3溶液和亚硫酸、硫酸都反应生成二氧化碳气体,不能鉴别硫酸,故b错误;
c.BaC12溶液和三氧化硫反应生成不溶于水,不溶于酸的白色沉淀,证明函硫酸根离子,故c正确;
d.二氧化硫气体通入Ba(NO3)2溶液会形成稀硝酸吧二氧化硫氧化为硫酸,也会生成不溶于酸的白色沉淀,不能鉴别三氧化硫,故d错误;
故答案为:FeSO4中铁元素与硫元素物质的量之比为1:1,根据得失电子守恒及元素守恒,有+6价的硫剩余,c;
④反应物为硫酸亚铁结晶水合物晶体受热分解生成氧化铁、二氧化硫、三氧化硫和水,结合原子守恒配平书写化学方程式为:2FeSO4•7H2O═Fe2O3+SO2↑+SO3+14H2O,
故答案为:2FeSO4•7H2O═Fe2O3+SO2↑+SO3+14H2O.
点评 本题考查了物质组成的实验探究和含量的测定方法分析,主要是物质性质、氧化还原反应电子守恒、物质检验等知识点,题目难度中等.


 互动英语系列答案
互动英语系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
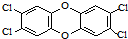 二噁英是一类芳香族化合物的多氯代衍生物的总称,结构稳定,难以被自然分解,是公认的最危险的致癌物质之一.如图是其中一种的结构.下列说法中不正确的是
二噁英是一类芳香族化合物的多氯代衍生物的总称,结构稳定,难以被自然分解,是公认的最危险的致癌物质之一.如图是其中一种的结构.下列说法中不正确的是| A. | 它能发生还原反应 | B. | 它能燃烧 | ||
| C. | 它的一溴取代物只有一种 | D. | 此分子中共平面的原子最多有18个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
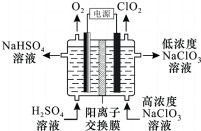 ClO2是高效杀菌消毒剂.用惰性电极电解NaC1O3溶液制备高纯C1O2的原理如下图所示.下列说法正确的是( )
ClO2是高效杀菌消毒剂.用惰性电极电解NaC1O3溶液制备高纯C1O2的原理如下图所示.下列说法正确的是( )| A. | 电解过程中,Na+向阴极区移动 | |
| B. | 电解产生的O2和ClO2在相同条件下的体积比为1:1 | |
| C. | 阴极的电极反应式是ClO3-+H2O+e-=ClO2↑+2OH- | |
| D. | 电解总反应的化学方程式是4NaClO3+4H2SO4$\frac{\underline{\;电解\;}}{\;}$O2↑+4ClO2↑+4NaHSO4+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 实验方案 |
| A | 检验溴乙烷是否发生消去反应 | 溴乙烷与NaOH乙醇溶液共热,将产物通入到Br2的CC14溶液中,观察溶液是否褪色 |
| B | 验证电离H+的能力 HClO>HCO3- | 向NaHCO3溶液中加入新制氯水,观察溶液中是否有气泡冒出 |
| C | 验证H2O与NH3的配位能力强弱 | 向CuSO4溶液中逐滴加入过量NH3•H2O,观察蓝色溶液是否最终转化为深蓝色溶液 |
| D | 检验Na2O2的强氧化性 | 向FeSO4溶液中加入少量Na2O2粉末,观察是否有红褐色沉淀生成 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 最高价氧化物对应水化物的碱性大小顺序一定是:X>Y | |
| B. | 离子半径和原子半径由大到小的顺序均为X>Y>Z>W | |
| C. | 氢化物的稳定性是Z>W;氢化物的沸点是Z<W | |
| D. | 还原性Zm->W(m+1)-,氧化性Xn+>Y(n+1)+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
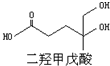 我国科学家屠呦呦因为发现青蒿素而获得2015年诺贝尔生理和医学奖.已知二羟甲戊酸是生物合成青蒿素的原料之一,下列关于二羟甲戊酸的说法正确的是( )
我国科学家屠呦呦因为发现青蒿素而获得2015年诺贝尔生理和医学奖.已知二羟甲戊酸是生物合成青蒿素的原料之一,下列关于二羟甲戊酸的说法正确的是( )| A. | 二羟甲戊酸的分子式为C6H10O4 | |
| B. | 能发生加成反应,不能发生取代反应 | |
| C. | 在铜的催化下与氧气反应的产物能发生银镜反应 | |
| D. | 1mol该有机物可以与足量金属钠反应产生33.6L H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
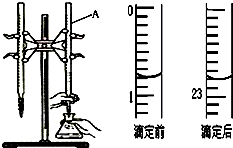 如图是用0.1000mol/L的盐酸滴定某未知浓度的NaOH溶液的示意图和某次滴定前、后的盛放盐酸滴定管中液面的位置.请回答:
如图是用0.1000mol/L的盐酸滴定某未知浓度的NaOH溶液的示意图和某次滴定前、后的盛放盐酸滴定管中液面的位置.请回答:| 实验 编号 | 待测NaOH溶液的体积(mL) | 滴定前盐酸的 体积读数(mL) | 滴定后盐酸的 体积读数(mL) |
| 1 | 20.00 | 1.20 | 23.22 |
| 2 | 20.00 | 2.21 | 24.21 |
| 3 | 20.00 | 1.50 | 23.48 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com