
【题目】2017年冬季,我国北方大部分地区出现严重雾霾天气,引起雾霾的PM2.5微细粒子包含(NH4)2SO4、NH4NO3、有机颗粒物及扬尘等。城市雾霾中还含有铜等重金属元素。
(1)N元素原子核外电子云的形状有___________种;基态铜原子的价电子排布式为___________,金属铜的晶体中,铜原子的堆积方式为___________。
(2)N和O中第一电离能较小的元素是___________;SO42-的空间构型___________。
(3)NO能被FeSO4溶液吸收生成配合物[Fe(NO)(H2O)5]SO4,该配合物中心离子的配位数为___________。
(4)测定大气中PM2.5浓度的方法之一是β-射线吸收法,β-射线放射源可用85Kr。已知Kr晶体的晶胞结构如图所示,晶胞边长为540pm,则该晶体的密度___________g/cm3(只列式不计算)(1pm=10-10cm)

【答案】2 3d104s1 面心立方堆积 O 正四面体 6 ![]()
【解析】
(1)N位于周期表中第2周期第ⅤA族,Cu位于周期表中第4周期第ⅠB族,铜原子的堆积方式为ABCABC……,据此分析判断;
(2)N为半满结构,较为稳定,第一电离能反常大,根据VSEPR理论判断SO42-的空间构型;
(3)NO和H2O为单齿配体,据此分析配位数;
(4)根据均摊法确定一个晶胞中含有的粒子数目,由ρ=![]() 计算晶体密度。
计算晶体密度。
(1)N位于周期表中第2周期第ⅤA族,则N元素核外电子排布式为1s22s22p3,核外电子云形状有2种;Cu位于周期表中第4周期第ⅠB族,则其价电子排布式为3d104s1,
金属铜的晶体中,铜原子的堆积方式为密置层ABCABC……堆积,所以铜原子的堆积方式为面心立方最密堆积,故答案为:2;3d104s1;面心立方最密堆积;
(2)N为半满结构,较为稳定,第一电离能反常大,所以N和O中第一电离能较小的元素是O;对于SO42-,根据VSEPR理论,价电子对数=4+![]() =4,VSEPR模型为四面体,所以其空间构型为正四面体,故答案为:O;正四面体;
=4,VSEPR模型为四面体,所以其空间构型为正四面体,故答案为:O;正四面体;
(3)NO能被FeSO4溶液吸收生成配合物[Fe(NO)(H2O)5]SO4,配体为NO和H2O,均为单齿配体,所以配位数为6,故答案为:6;
(4)顶点粒子占![]() ,面心粒子占
,面心粒子占![]() ,则1个晶胞中含有粒子数目为8×
,则1个晶胞中含有粒子数目为8×![]() +6×
+6×![]() =4个,不妨取1mol这样的晶胞,1mol晶胞的质量为m=4×85g,1mol晶胞体积为V=(540×10-10)3×6.02×1023cm3,则晶体密度为ρ=
=4个,不妨取1mol这样的晶胞,1mol晶胞的质量为m=4×85g,1mol晶胞体积为V=(540×10-10)3×6.02×1023cm3,则晶体密度为ρ=![]() =
=![]() g/cm3,故答案为:
g/cm3,故答案为:![]() (或
(或![]() )。
)。


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】四种短周期元素X、Y、Z和W在周期表中的位置如图所示,原子序数之和为48,下列说法不正确的是
X | Y | |
Z | W |
A.原子半径(r)大小比较:![]()
B.X和Y可形成共价化合物XY、![]() 等化合物
等化合物
C.Y的非金属性比Z的强,所以Y的最高价氧化物的水化物酸性大于Z
D.Z的最低价单核阴离子的失电子能力比W的强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)微生物燃料电池是指在微生物的作用下将化学能转化为电能的装置。某微生物燃料电池的工作原理如图所示:
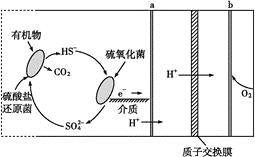
HS-在硫氧化菌作用下转化为SO![]() 的反应式是__。
的反应式是__。
(2)PbSO4热激活电池可用作火箭、导弹的工作电源,基本结构如图所示,其中作为电解质的无水LiCl—KCl受热熔融后,电池即可瞬间输出电能。该电池总反应为PbSO4+2LiCl+Ca=CaCl2+Li2SO4+Pb。
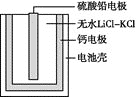
①放电过程中,Li+向__(填“负极”或“正极”)移动。
②负极反应式为__。
③电路中每转移0.2mol电子,理论上生成__gPb。
(3)氨氧燃料电池具有很大的发展潜力。氨氧燃料电池工作原理如图所示。
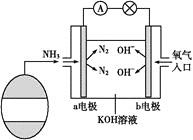
①a电极的电极反应式是__。
②一段时间后,需向装置中补充KOH,请依据反应原理解释原因:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以CO2和Na2O2为原料,制取纯净干燥的O2,实验装置如下:

下列说法不正确的是
A. 装置②中试剂可以是NaOH溶液
B. 装置③的作用是干燥O2
C. 收集氧气应选择装置a
D. 装置②、③之间应增加盛澄清石灰水的洗气瓶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(10分)有机物A常用于食品行业。已知9.0 g A在足量O2中充分燃烧,混合气体依次通过足量的浓硫酸和碱石灰,分别增重5.4 g和13.2 g,经检验剩余气体为O2。
(1)A分子的质谱图如下图所示,从图中可知其相对分子质量是90,则A的分子式是_______________。

(2)A能与NaHCO3溶液发生反应,A一定含有的官能团名称是__________________。
(3)A分子的核磁共振氢谱有4个峰,峰面积之比是1:1:1:3,则A 的结构简式是_________________________________。
(4)0.1 mol A与足量Na反应,在标准状况下产生H2的体积是__________L。
(5)A在一定条件下可聚合得到一种聚酯,用于制造手术缝合线,其反应的化学方程式是________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】指出下列原子的杂化轨道类型及分子的结构式、空间构型。
(1)CO2分子中的C采取______杂化,分子的结构式为______,空间构型呈______;
(2)CH2O中的C采取______杂化,分子的结构式为______,空间构型呈______;
(3)H2S分子中的S采取______杂化,分子的结构式为______,空间构型呈______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列装置完成相关实验,不合理的是( )
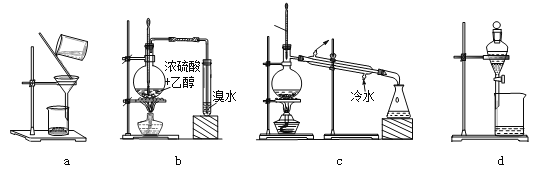
A. 用a趁热过滤提纯苯甲酸B. 用b制备并检验乙烯
C. 用c除去溴苯中的苯D. 用d分离硝基苯与水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苏合香醇可以用作食用香精,其结构简式如图所示。

(1)苏合香醇的分子式为_____________,它不能发生的有机反应类型有(填数字序号)_____________。
①取代反应 ②加成反应 ③消去反应 ④加聚反应 ⑤氧化反应 ⑥水解反应
(2)有机物丙是一种香料,其合成路线如图。其中A为烃,相对分子质量为56;甲的相对分子质量通过质谱法测得为88,它的核磁共振氢谱显示只有三组峰;乙与苏合香醇互为同系物。

已知:R-CH=CH2  R-CH2CH2OH
R-CH2CH2OH
①A的结构简式是_____________。
②写出由B到C的化学反应方程式_____________。
③写出C与新制氢氧化铜悬浊液反应的化学反应方程式_____________。
④B的同分异构体能与钠反应生成氢气,不能发生催化氧化反应,其结构简式_____________。
⑤丙中含有两个—CH3,则甲与乙反应的化学方程式为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴、碘主要存在于海水中,有“海洋元素”的美称。海水中的碘主要富集在海带中,我国海带产量居世界第一位,除供食用外,大量用于制碘。提取碘的途径如下图所示,下列有关叙述正确的是

A. 此装置进行操作①
此装置进行操作①
B.②③操作中所用到的玻璃仪器有:玻璃棒、烧杯、分液漏斗
C.④中当1molH2O2氧化I-时,转移电子数为2NA
D.溶剂X可选用酒精或苯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com